Ung thư phổi giai đoạn 3B: Chiến lược điều trị cá nhân hóa với hóa xạ trị và miễn dịch 2025
16:16 - 04/05/2025
Phân tích chuyên sâu ung thư phổi giai đoạn IIIB: vai trò phân loại hạch N2, giới hạn phẫu thuật, PET/CT staging, hóa xạ trị đồng thời và hiệu quả sống còn khi thêm Durvalumab hoặc thuốc đích duy trì sau điều trị.
So sánh thời gian sống không tiến triển trong ung thư phổi giai đoạn 4: phác đồ nào giữ bệnh đứng yên lâu nhất?
Chọn đúng thuốc – Cơ hội sống dài hơn cho bệnh nhân ung thư phổi giai đoạn 4
Chọn đúng thuốc ung thư phổi giai đoạn 4 để sống lâu hơn
Các loại vắc xin điều trị ung thư: cơ chế, hiệu quả, hướng điều trị tiếp theo
Ung thư phổi không tế bào nhỏ giai đoạn IIIB: Đặc điểm, điều trị và thách thức trong cá nhân hóa chiến lược lâm sàng
Giới thiệu
Ung thư phổi không tế bào nhỏ (NSCLC) giai đoạn IIIB đại diện cho nhóm bệnh tiến xa nhưng chưa có bằng chứng di căn xa rõ ràng (M0). Tuy không còn phù hợp với các chiến lược điều trị triệt căn bằng phẫu thuật, nhưng nhóm bệnh nhân này vẫn có thể đạt được kiểm soát dài hạn nếu được chẩn đoán chính xác và lựa chọn mô thức điều trị phù hợp. Giai đoạn IIIB là trọng tâm trong các thử nghiệm về hóa xạ trị đồng thời và miễn dịch duy trì.
Phân loại TNM 8 – Định nghĩa giai đoạn IIIB
Theo phân loại TNM phiên bản 8:
Giai đoạn IIIB bao gồm:
T1–T2a N3 M0
T3–T4 N2 M0
Đặc điểm chính:
T3/T4: U lớn (>7 cm), xâm lấn cơ quan lân cận, nhiều khối u trong cùng hoặc khác thùy cùng bên.
N3: Hạch rốn phổi hoặc hạch trung thất đối bên, hạch dưới thanh quản, hạch thượng đòn.
=> Đây là các tình huống mà phẫu thuật gần như không thể thực hiện, hoặc chỉ mang tính giảm nhẹ, và xạ trị trở thành công cụ điều trị nền tảng.
Ý nghĩa phân loại hạch N2 trong giai đoạn IIIB
Phân loại và đặc điểm của hạch N2 trong giai đoạn IIIB có ý nghĩa đặc biệt quan trọng vì:
Xác định chính xác giai đoạn bệnh: N2 đi kèm với T3–T4 là thành phần chính của nhóm IIIB, thường loại trừ khả năng phẫu thuật triệt căn và cần lập kế hoạch hóa xạ trị nghiêm ngặt.
Lựa chọn chiến lược điều trị: N2 đơn trạm có thể đáp ứng tốt với hóa xạ trị triệt căn và có khả năng duy trì miễn dịch với Durvalumab; trong khi N2 đa trạm thường tiên lượng xấu hơn và cần cân nhắc hướng điều trị toàn thân.
Dự đoán đáp ứng: Bệnh nhân có N2 đa trạm thường mang tải lượng bệnh cao, nguy cơ di căn vi thể lớn và khả năng đáp ứng kém hơn với miễn dịch.
Kiểm soát sau xạ trị: PET/CT có thể giúp đánh giá lại mức độ hoạt tính chuyển hóa của hạch N2 sau điều trị ban đầu, từ đó hỗ trợ lựa chọn duy trì miễn dịch hay thay đổi phác đồ.
Việc xác định tính chất và số lượng hạch N2 cần được thực hiện kỹ lưỡng bằng các phương tiện hình ảnh học (PET/CT, CT) và sinh thiết xác nhận (EBUS-TBNA hoặc mediastinoscopy) nếu cần thiết.
Thách thức trong giai đoạn IIIB
1. Không còn khả năng phẫu thuật triệt căn
Phẫu thuật hầu như không được chỉ định với N3.
T4 xâm lấn các cấu trúc quan trọng như tim, thân đốt sống, khí quản, động mạch chủ => nguy cơ cao và hiệu quả thấp.
2. Xạ trị có giới hạn kỹ thuật
U lớn hoặc đa ổ => khó đạt được liều xạ đủ để kiểm soát.
Gần cấu trúc quan trọng (tim, thực quản, tủy sống).
3. Sinh học khối u dị heterogene và khó kiểm soát toàn thân
Khối u có nguy cơ di căn vi thể cao.
Tỷ lệ đột biến EGFR/ALK/ROS1 thấp hơn, nhưng cần làm xét nghiệm sớm.
Đặc điểm vi mô ảnh hưởng khả năng đáp ứng miễn dịch.
Vai trò của PET/CT và CT trong giai đoạn IIIB
Chẩn đoán hình ảnh giữ vai trò then chốt trong việc xác định chính xác mức độ lan rộng của u và đánh giá khả năng điều trị triệt căn ở giai đoạn IIIB.
1. CT ngực (Chest CT):
Là kỹ thuật cơ bản đầu tiên, giúp đánh giá kích thước u nguyên phát (T3/T4), mức độ xâm lấn mô lân cận (tim, khí quản, thực quản), và hạch trung thất hoặc hạch thượng đòn.
CT cũng là nền tảng để lập kế hoạch xạ trị, xác định GTV/CTV/PTV.
Tuy nhiên, CT có thể bỏ sót tổn thương di căn nhỏ hoặc khó phân biệt giữa viêm và ung thư.
2. PET/CT toàn thân:
PET/CT giúp đánh giá chuyển hóa của khối u và hạch, từ đó phân biệt tổn thương di căn với tổn thương viêm hoặc lành tính.
Đặc biệt quan trọng để phát hiện hạch N3 và loại trừ di căn xa (M1), đảm bảo rằng bệnh nhân thực sự nằm trong phạm vi có thể điều trị triệt căn.
PET/CT còn giúp tránh điều trị sai hướng như hóa xạ trị cho bệnh nhân thực tế đã ở giai đoạn IV.
Lưu ý: PET/CT có thể gây quá chẩn đoán do bắt FDG ở hạch viêm, cần sinh thiết xác nhận nếu ảnh hưởng đến kế hoạch điều trị.
PET/CT và CT là hai công cụ bổ trợ lẫn nhau. Việc phối hợp cả hai giúp xác định đúng bệnh nhân đủ điều kiện hóa xạ trị đồng thời và Durvalumab duy trì.
Vai trò của phẫu thuật trong giai đoạn IIIB
Phẫu thuật không còn là phương pháp điều trị tiêu chuẩn cho giai đoạn IIIB do các đặc điểm bệnh lý phức tạp như hạch N3 và u xâm lấn các cấu trúc trung tâm (T4). Theo các hướng dẫn quốc tế (NCCN, ESMO):
N3 (hạch đối bên, hạch thượng đòn...) là chống chỉ định tương đối với phẫu thuật triệt căn.
T4 với xâm lấn tim, thân đốt sống, khí quản, động mạch chủ... làm tăng nguy cơ biến chứng nặng và tỷ lệ tử vong hậu phẫu.
Tuy nhiên, trong một số tình huống rất hiếm và được lựa chọn kỹ lưỡng, phẫu thuật có thể được cân nhắc:
N2 đơn trạm, đáp ứng hoàn toàn sau điều trị tân bổ trợ.
T3 hoặc T4 giới hạn, không xâm lấn các cấu trúc không thể phẫu thuật.
Những trường hợp này cần được đánh giá cẩn trọng qua hội chẩn đa chuyên khoa (MDT), và thường là trong bối cảnh nghiên cứu lâm sàng hoặc tại trung tâm có kinh nghiệm cao.
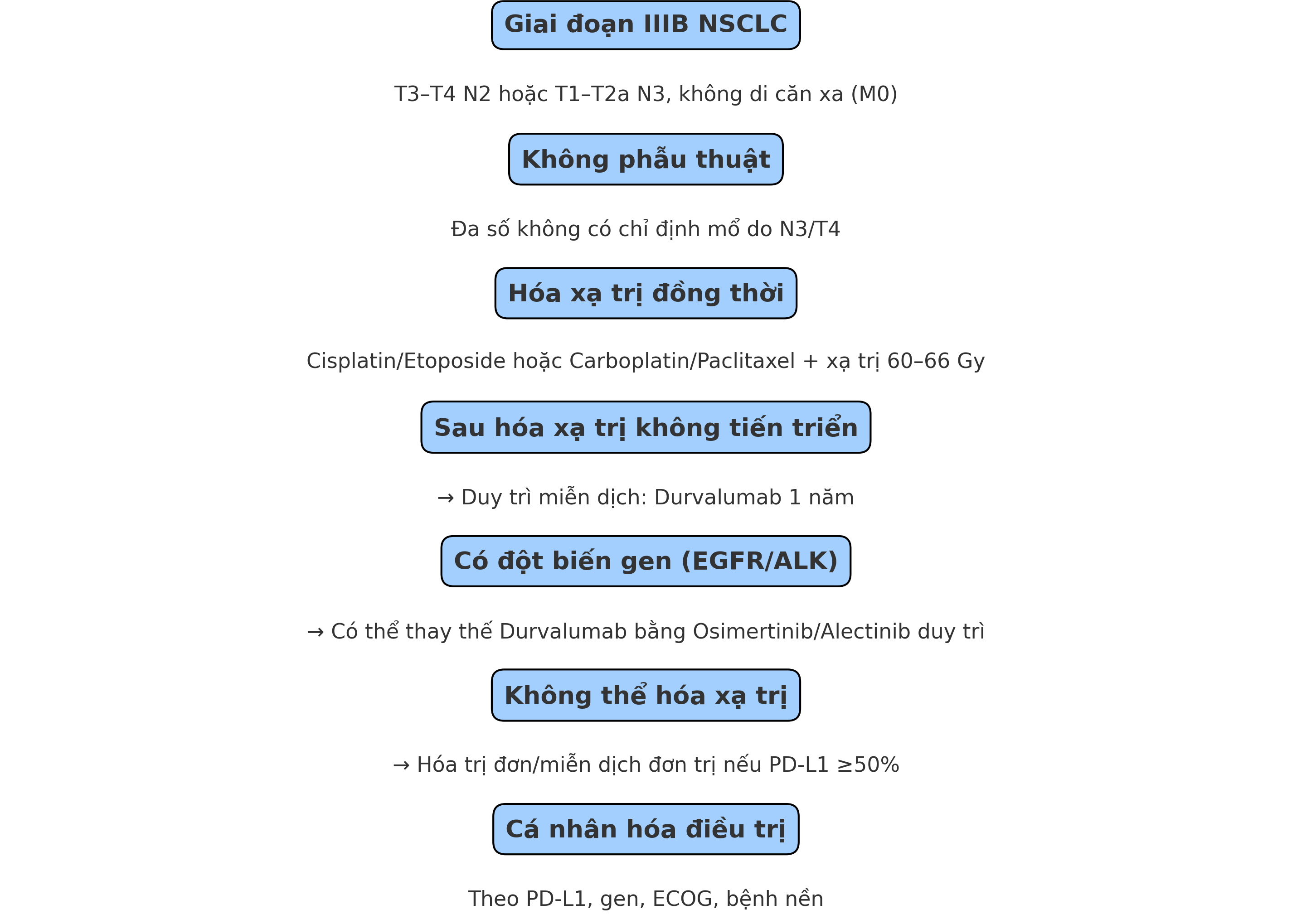
Chiến lược điều trị tiêu chuẩn
1. Hóa xạ trị đồng thời (cCRT – concurrent chemoradiotherapy)
Là liệu pháp tiêu chuẩn được khuyến cáo bởi NCCN, ESMO, ASCO cho NSCLC giai đoạn IIIB.
Lý do lựa chọn:
Cải thiện tỷ lệ sống so với xạ trị đơn thuần hoặc hóa xạ trị tuần tự.
Kiểm soát tại chỗ tốt hơn và có thể diệt các tế bào vi di căn.
Phác đồ khuyến cáo:
Cisplatin + Etoposide hoặc Carboplatin + Paclitaxel đồng thời với xạ trị 60–66 Gy trong 6 tuần.
Cần theo dõi sát độc tính cấp: viêm thực quản, giảm bạch cầu.
2. Miễn dịch duy trì và thuốc đích sau hóa xạ trị (Consolidation Therapy)
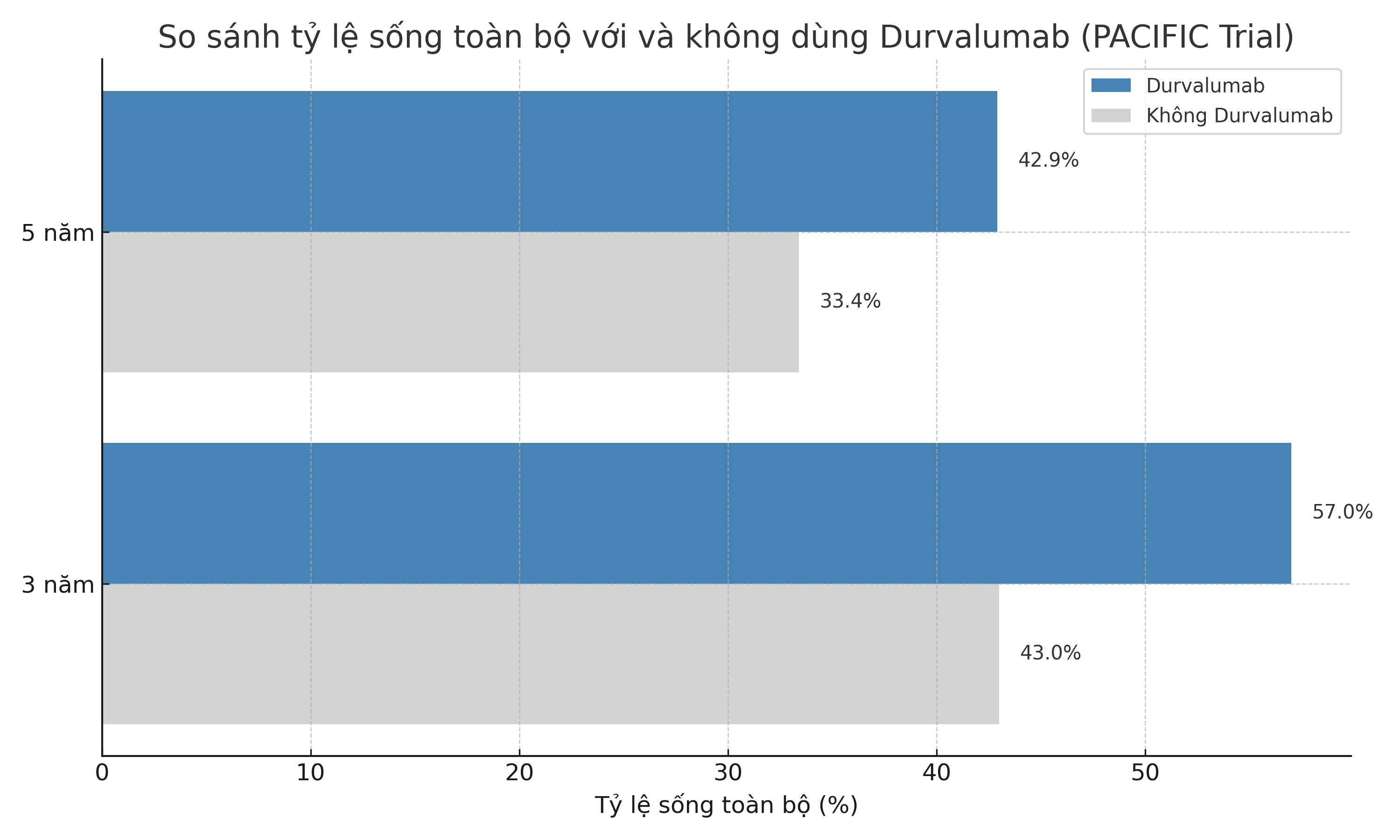
Dựa trên nghiên cứu PACIFIC:
Sau hóa xạ trị thành công (không tiến triển), bệnh nhân được duy trì Durvalumab 10 mg/kg mỗi 2 tuần trong 12 tháng.
Kết quả:
Tăng đáng kể sống không bệnh (PFS): 17,2 tháng với Durvalumab so với 5,6 tháng ở nhóm giả dược.
Tăng sống toàn bộ (OS):
3 năm: 57% với Durvalumab vs. 43% giả dược.
5 năm: 42,9% với Durvalumab vs. 33,4% giả dược (theo cập nhật PACIFIC 5-year analysis – NEJM 2022).
Tác dụng phụ miễn dịch chấp nhận được, chủ yếu độ 1–2, bao gồm viêm phổi do miễn dịch, viêm da, và rối loạn nội tiết.
Vai trò thuốc đích sau hóa xạ trị:
Các thử nghiệm mới đang nghiên cứu vai trò bổ sung Osimertinib (EGFR+) hoặc Alectinib (ALK+) sau hóa xạ trị.
Dữ liệu sơ bộ cho thấy bệnh nhân mang đột biến EGFR có thể không hưởng lợi rõ từ Durvalumab, nhưng Osimertinib duy trì có thể cải thiện sống không bệnh và làm chậm tái phát (theo kết quả từ nhóm phụ trong ADAURA).
=> Điều này mở ra hướng cá nhân hóa sau hóa xạ trị: miễn dịch cho nhóm không đột biến, và thuốc đích duy trì cho nhóm có gen nhắm trúng đích.
Khuyến cáo:
Chỉ áp dụng cho bệnh nhân không có tiến triển sau hóa xạ trị.
Nên xét nghiệm PD-L1 trước nếu điều kiện cho phép.
3. Các mô thức thay thế khi không thể hóa xạ trị
Hóa trị đơn trị hoặc kép nếu không xạ trị được do bệnh nền.
Miễn dịch đơn trị (Pembrolizumab, Nivolumab) nếu PD-L1 ≥50% và không có đột biến EGFR/ALK.
Điều trị đích (Osimertinib, Alectinib, Crizotinib...) nếu có đột biến – lưu ý miễn dịch có hiệu quả thấp với nhóm này.
Cá nhân hóa điều trị giai đoạn IIIB
1. Dựa trên xét nghiệm gen:
EGFR+: ưu tiên Osimertinib => tránh miễn dịch.
ALK+: Alectinib hoặc Brigatinib.
ROS1, BRAF, MET...: theo chỉ định thuốc đích tương ứng.
2. Dựa trên PD-L1:
≥50%: cân nhắc miễn dịch đơn trị nếu không hóa xạ trị được.
1–49%: miễn dịch kết hợp hóa trị.
<1%: ưu tiên hóa trị ± miễn dịch nếu thể trạng tốt.
3. Dựa trên thể trạng và bệnh đi kèm:
ECOG 0–1: ưu tiên hóa xạ trị đồng thời + Durvalumab.
ECOG ≥2: hóa trị đơn, miễn dịch đơn, hoặc chăm sóc giảm nhẹ tùy mục tiêu.
Sơ đồ tiếp cận điều trị giai đoạn 3B
Vai trò của hội chẩn đa chuyên khoa (MDT)
Đánh giá khả năng xạ trị an toàn.
Lập kế hoạch hóa xạ trị đồng thời chuẩn.
Lựa chọn bệnh nhân phù hợp với Durvalumab.
Hướng dẫn theo dõi độc tính phức hợp hóa xạ – miễn dịch.
Tương lai và nghiên cứu mở rộng
Nghiên cứu bổ sung miễn dịch sớm trong giai đoạn hóa xạ trị.
Sử dụng liệu pháp nhắm đích phối hợp xạ trị.
Biomarker mới ngoài PD-L1 (TMB, ctDNA) để chọn bệnh nhân.
Kết luận
Giai đoạn IIIB NSCLC là nhóm bệnh khó điều trị nhưng có thể đạt sống còn dài hạn nếu phối hợp đúng chiến lược. Hóa xạ trị đồng thời + Durvalumab duy trì là tiêu chuẩn vàng hiện nay. Tuy nhiên, điều trị cần cá nhân hóa dựa trên gen, PD-L1 và thể trạng. Hội chẩn đa chuyên khoa giữ vai trò trung tâm để lựa chọn đúng bệnh nhân, đúng thời điểm và tối ưu hiệu quả điều trị.
Đọc thêm:
Phác đồ chuẩn 2025 điều trị ung thư phổi giai đoạn 3
So sánh Durvalumab và Osimertinib trong giai đoạn 3
Phân loại giai đoạn 3 và phác đồ điều trị tương ứng
Cần tư vấn chuyên sâu về các thuốc điều trị ung thư phổi:
- ThS – BS Trần Khôi
- Bệnh viện Phổi Hà Nội – 44 Thanh Nhàn, Hai Bà Trưng
- Zalo: 0983 812 084 – Hotline: 0913 058 294
- Facebook: Bác sĩ Trần Khôi
- Kênh YouTube: Thạc sĩ Bác sĩ Trần Khôi – Chữa bệnh ung thư phổi




