ĐỘT BIẾN GEN KRAS TRONG UNG THƯ PHỔI
15:26 - 14/09/2023
Đặc điểm về đột biến gen Kras G12C trong ung thư phổi không tế bào nhỏ, dịch tễ, phân tử và điều trị.
So sánh thời gian sống không tiến triển trong ung thư phổi giai đoạn 4: phác đồ nào giữ bệnh đứng yên lâu nhất?
Chọn đúng thuốc – Cơ hội sống dài hơn cho bệnh nhân ung thư phổi giai đoạn 4
Chọn đúng thuốc ung thư phổi giai đoạn 4 để sống lâu hơn
Các loại vắc xin điều trị ung thư: cơ chế, hiệu quả, hướng điều trị tiếp theo
ĐỘT BIẾN GEN KRAS G12C TRONG UNG THƯ PHỔI KHÔNG TẾ BÀO NHỎ
KRAS là gen gây ung thư bị đột biến phổ biến nhất trong bệnh ung thư phổi không phải tế bào nhỏ, không vảy, giai đoạn tiến triển (NSCLC). Trong số các đột biến KRAS, G12C là phổ biến nhất (~40%), chiếm 10–13% NSCLC không vảy. Các thuốc ức chế chọn lọc KRAS G12C: sotorasib và adagrasib được chấp thuận điều trị từ bước 2.
Tỉ lệ khác nhau về đột biến KRAS G12C: khoảng 8,9–19,5% ở Hoa Kỳ, 9,3–18,4% ở Châu Âu, 6,9–9,0% ở Châu Mỹ Latinh và 1,4–4,3% ở Châu Á. Các đồng đột biến KRAS G12C như STK11 , KEAP1 và TP53 đang ngày càng tăng gặp ở 10,3–28,0%, 6,3–23,0% và 17,8–50,0% bệnh nhân, tương ứng.
1. Vai trò của KRAS trong cân bằng nội môi tế bào và ung thư phổi
KRAS và các chất tương đồng của nó là NRAS và HRAS thuộc họ protein RAS GTPase. KRAS ở bên trong của màng tế bào và tạo các tầng tín hiệu điều chỉnh sự tăng sinh, sự sống và sự biệt hóa của tế bào. KRAS tồn tại ở trạng thái không hoạt động sẽ gắn với GDP (KRAS-GDP) và trạng thái gắn với GTP hoạt động (KRAS-GTP).
Sự chuyển đổi giữa KRAS-GDP không hoạt động và KRAS-GTP hoạt động phụ thuộc vào yếu tố tăng trưởng và protein tác động gồm các yếu tố trao đổi nucleotide guanine (GEF) và protein kích hoạt GTPase (GAP).
Bình thường KRAS ở dạng KRAS-GDP không hoạt động. Kích hoạt yếu tố tăng trưởng của thụ thể tyrosine kinase (RTK; ví dụ: EGFR, ROS1 hoặc ALK), ví dụ như Son of Sevenless-1 (SOS1), đi qua màng tế bào và tương tác với KRAS-GDP sẽ giải phóng GDP và liên kết GTP để hình thành KRAS-GTP hoạt động. Điều này gây ra sự thay đổi về hình dạng cho phép KRAS-GTP liên kết và kích hoạt các protein tác động bao gồm RAF kinase, tiểu đơn vị p110 của PI3K và chất kích thích phân ly nucleotide Ral guanine (RALGDS) thông qua các vùng liên kết RAS trong các protein này.
Việc kích hoạt KRAS GTP dẫn đến kích thích các đường dẫn truyền tín hiệu riêng lẻ thúc đẩy sự tăng sinh, sống sót và biệt hóa tế bào. Tín hiệu kích hoạt bị chấm dứt khi KRAS-GTP liên kết với GAP, dẫn tới tăng tốc hoạt động GTPase của KRAS và chuyển KRAS-GTP hoạt động thành KRAS-GDP không hoạt động.
Các đột biến KRAS dẫn đến đột biến protein KRAS với tỉ lệ chuyển đổi từ KRAS-GTP sang KRAS-GDP giảm, tạo ra KRAS hoạt động khởi tạo các tín hiệu nội bào độc lập với tín hiệu ngoại bào, dẫn đến tăng sinh tế bào gây ung thư, sống sót và biệt hóa.
Các chiến lược điều trị với các chất ức chế tương tự nucleotide để cạnh tranh GTP và/hoặc GDP liên kết với KRAS không hiệu quả do ái lực cực đại của KRAS đối với cả GTP và GDP, đồng thời nồng độ GTP và GDP nội bào cao. Điều này trái ngược với ái lực ATP tương đối thấp đối với kinase, điều này cho phép phát triển các chất ức chế kinase có tác dụng điều trị hiệu quả. Các nghiên cứu cấu trúc sâu hơn cho thấy thiếu các túi trên bề mặt KRAS wild-type cho phép liên kết các phân tử nhỏ để ức chế hoạt động của nó.
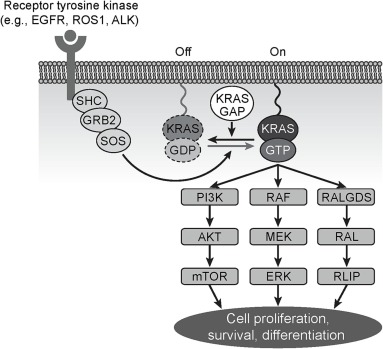
2. Dịch tễ học về đột biến kích hoạt KRAS : tỷ lệ mắc và sinh học ở NSCLC tiến triển
Đột biến KRAS xảy ra ở ∼30% ung thư biểu mô tuyến phổi ở các nước phương Tây. Ngược lại, với tỷ lệ thấp hơn 5-12% ở các nước châu Á. Các dưới nhóm gen RAS khác ít khi bị đột biến trong NSCLC, là khoảng ∼1% đối với NRAS và <1% đối với HRAS.
Trên 80% đột biến điểm KRAS xảy ra ở codon 12, nằm gần vị trí gắn nucleotide của KRAS và liền kề với các công tắc protein tác động. Đột biến KRAS ở codon 12 bao gồm chuyển đổi G>T hay gặp dẫn đến thay thế glycine-to-cysteine (p.G12C) hoặc thay thế glycine-to-valine (p. G12V). Đột biến chuyển tiếp G>A dẫn đến sự thay thế axit glycine-aspartic (tr. G12D). Các đột biến codon 12 KRAS khác bao gồm KRAS G12A , KRAS G12S , KRASG12R và KRAS G12F. Mặc dù ít phổ biến hơn, các đột biến KRAS khác bên ngoài codon 12, gồm đột biến ở codon 13 (KRAS G13C) và codon 61 (KRAS Q61H).
Việc thay thế glycine ở codon 12 bằng bất kỳ chất nào khác ngoài proline sẽ tạo ra trở ngại không gian ngăn cản sự liên kết của GAP với KRAS và dẫn đến giảm tỷ lệ chuyển đổi từ KRAS-GTP sang KRAS-GDP, do đó duy trì KRAS-GTP hoạt động.
Tiếp xúc các hydrocacbon thơm đa vòng gây ung thư trong khói thuốc lá tạo điều kiện thuận lợi cho sự chuyển đổi G>T gây đột biến KRASG12C. Ngược lại, các chuyển đổi G>A dẫn đến KRAS G12D phổ biến ở người không hút thuốc.
KRAS G12C là biến thể phổ biến nhất ~ 40% ung thư biểu mô tuyến có đột biến KRAS, chiếm 10–13% NSCLC tiến triển, không vảy ở các nước phương Tây. Sự khác biệt về thói quen hút thuốc có thể giải thích một phần sự khác biệt về tỷ lệ đột biến KRAS giữa phương Tây và phương Đông.
3. Những tiến bộ trong điều trị NSCLC đột biến KRAS
Ái lực cao của GTP đối với KRAS và việc thiếu ổ liên kết phù hợp trên bề mặt KRAS đã khiến việc phát triển các chất ức chế trực tiếp KRAS trở nên khó khăn. Phát hiện mang tính đột phá về ổ nhỏ (P2) trong KRASG12C của Ostrem và cộng sự vào năm 2013 sau đó đã mở đường cho sự phát triển của các phân tử nhỏ ức chế trực tiếp KRAS G12C và dẫn đến sự chấp thuận hai chất ức chế chọn lọc G12C cùng với nhiều loại khác hiện đang được phát triển và các chiến lược trị liệu kết hợp cũng đang được theo đuổi.
Chất ức chế phân tử nhỏ của KRAS G12C
Các phân tích phát hiện ra rằng vùng cysteine 12 của KRAS G12C đột biến nằm liền kề với ổ P2 chỉ hiện diện ở trạng thái KRAS-GDP không hoạt động. Vùng cysteine 12 này có thể hình thành liên kết cộng hóa trị không thể đảo ngược với các chất ức chế phân tử nhỏ và khóa KRAS G12C ở trạng thái KRAS-GDP không hoạt động và chặn tín hiệu tế bào gây ung thư.
Các thuốc ức chế phân tử nhỏ gồm sotorasib (AMG 510) và adagrasib (MRTX849) hiện được phê duyệt để sử dụng lâm sàng và các chất ức chế khác như GDC-6036, JDQ443 và JNJ-74699157 (ARS-3248) đang được phát triển.
Nghiên cứu CodeBreaK với ung thư phổi đã được điều trị trước đó và tiến triển cục bộ hoặc di căn có đột biến KRAS G12C. Với liều sotorasib khuyến cáo là 960 mg uống hàng, tỉ lệ đáp ứng (ORR) là 37,1%, thời gian đáp ứng trung bình là 11,1 tháng, thời gian sống thêm không tiến triển trung bình (PFS) là 6,8 tháng và thời gian sống thêm trung bình là 12,3 tháng.
Thử nghiệm CodeBreaK 200 so sánh sotorasib 960mg/ngày với docetaxel 75 mg/m 2 mỗi 3 tuần ở bệnh nhân đã điều trị trước đó. Sotorasib đã chứng minh PFS dài hơn có ý nghĩa thống kê so với docetaxel (PFS trung bình: 5,6 so với 4,5 tháng; [HR] 0,66, P = 0,002) và tỉ lệ PFS 12 tháng là 24,8% so với 10,1%. Sotorasib có thời gian đáp ứng trung bình nhanh hơn (1,4 so với 2,8 tháng), thời gian đáp ứng trung bình dài hơn (8,6 so với 6,8 tháng) và tỉ lệ kiểm soát bệnh cao hơn (82,5% so với 60,3%) so với docetaxel. Sotorasib được dung nạp tốt với tỉ lệ mắc các tác dụng phụ liên quan đến điều trị độ ≥ 3 (TRAE; 33% so với 40%) và TRAE nghiêm trọng (11% so với 23%) thấp hơn so với docetaxel. Hiện tại, sotorasib đang được đánh giá là phương pháp điều trị đầu tiên trong thử nghiệm giai đoạn II.
Dữ liệu từ thử nghiệm KRYSTAL - 1 của adagrasib đã chứng minh tính an toàn và hiệu quả đơn trị liệu ở NSCLC có KRAS G12C đã được điều trị trước đó. Với liều adagrasib 600 mg uống x hai lần mỗi, ORR là 42,9%, thời gian đáp ứng trung bình là 8,5 tháng, PFS trung bình là 6,5 tháng và thời gian sống thêm trung bình là 12,6 tháng. Adagrasib hiện đang được so sánh với docetaxel trong thử nghiệm pha III (KRYSTAL-12) và đang được đánh giá điều trị bước 1 trong thử nghiệm pha II (KRYSTAL-7).
4. Tóm tắt
KRAS là đột biến gây ung thư phổ biến nhất ở NSCLC tiến triển; với KRAS G12C là biến thể phổ biến nhất (∼40%), chiếm 10–13% tổng số bệnh nhân phương Tây mắc ung thư biểu mô tuyến phổi. Đột biến KRAS có thể xảy ra cùng các đột biến gen cụ thể làm thay đổi tiên lượng bệnh, (đồng thời với đột biến STK11 hoặc KEAP1 có vẻ liên quan đến kết quả kém khi điều trị bằng hóa trị liệu miễn dịch)
Hiện nay đã có 2 loại thuốc nhắm đích phân tử nhỏ được chấp thuận điều trị đột biến gen Kras G12C là sotorasib và adagrasib.




