ĐỘT BIẾN EGFR TRONG UNG THƯ PHỔI
10:43 - 17/08/2023
Đột biến EGFR, cấu trúc phân tử và các loại biến đổi trong ung thư phổi
So sánh thời gian sống không tiến triển trong ung thư phổi giai đoạn 4: phác đồ nào giữ bệnh đứng yên lâu nhất?
Chọn đúng thuốc – Cơ hội sống dài hơn cho bệnh nhân ung thư phổi giai đoạn 4
Chọn đúng thuốc ung thư phổi giai đoạn 4 để sống lâu hơn
Các loại vắc xin điều trị ung thư: cơ chế, hiệu quả, hướng điều trị tiếp theo
ĐỘT BIẾN EGFR VÀ Ý NGHĨA TRONG UNG THƯ PHỔI KHÔNG TẾ BÀO NHỎ
1. Tổng quan về EGFR
EGFR là một receptor của yếu tố phát triển biểu bì người, gồm có 4 loại khác nhau gồm: EGFR (HER1), HER2, HER3, HER4. Các protein này được mã hóa bởi các gen khác nhau nằm trên NST ở các vị trí 7, 17, 12 và 2 tương ứng.
Các chất gắn hòa tan ngoại bào đã được xác định tương ứng với các receptor EGFR, HER3, HER4; còn với HER2 thì chưa xác định rõ chất gắn. Các chất có thể gắn với receptor EGFR là yếu tố phát triển biểu bì EGFR và yếu tố phát triển chuyển dạng alpha TGF-α.
Sau khi gắn với chất gắn, receptor EGFR sẽ trải qua sự nhị trùng hóa đồng dạng hoặc dị dạng chủ yếu với HER2 hoặc các protein khác của gia đình EGFR, và tự phosphoryl hóa ở vị trí tyrosine đặc hiệu ở phần nội bào.
Sự tự phosphoryl hóa tyrosine nội bào sẽ hoạt hóa các con đường tín hiệu xuôi dòng gồm: con đường protein MAPK: Ras/Raf/mitogen-activated protein kinase và con đường PI3K-Akt: phosphatidylinositol 3’-kinase. Sự hoạt hóa Ras khởi đầu cho các bước phosphoryl hóa dẫn tới hoạt hóa con đường MAPKs. Con đường MAPKs, ERK1, ERK2 sau đó điều hòa sao chép gen liên quan tới sự biệt hóa, sống sót và chuyển dạng tế bào.
Sự nhị trùng hóa giữa EGFR và HER2 là cơ chế chuyển dạng ác tính quan trọng trong nhiều loại u. Với dòng tế bào NIH3T3 không có sự bộc lộ của gia đình protein HER được dùng để đánh giá khả năng nhị trùng hóa dị dạng HER khác nhau gây ra sự phát triển khối u bởi các kết hợp khác nhau giữa các protein HER.
Tế bào bộc lộ nhị trùng hóa đồng dạng HER2, HER3, HER4 không có khả năng kích thích u phát triển, trong khi chỉ bộc lộ EGFR có đặc tính sinh ung thư yếu. Bộc lộ đồng thời HER2/HER3 có khả năng kích thích u phát triển; trong khi kết hợp HER1/HER3, HER1/HER4 thì không. Ngược lại nhị trùng EGFR/HER2 có khả năng sinh u mạnh mẽ.
EGFR và HER2 bị quá bộc lộ ở các khối u đặc của phổi, đầu cổ, vú, thận, đại tràng, buồng trứng, tuyến tiền liệt, não và bàng quang. Đồng thời quá bộc lộ protein EGFR, HER2 thể hiện hoạt tính sinh học EGFR và có khả năng cao nhất bộc lộ các marker biệt hóa.
Bởi sự tăng khả năng nhị trùng dị dạng với HER khác nên HER2 là thành viên nhị trùng chủ yếu trong các receptor HER. Cơ chế HER2 khuếch đại hoạt tính nguyên phân EGFR tương tự sự nhị trùng này.
2. Cơ chế điều hòa xuôi dòng EGFR
Trong UTPKTBN, EGFR thường bị điều hòa xuôi dòng. Sự kiện chính gây ra vấn đề này là quá bộc lộ protein, khuếch đại số bản sao gen hoặc đột biến gen.
a. Quá bộc lộ EGFR
Quá bộc lộ EGFR gặp ở 85% UTPKTBN mặc dù vậy giá trị tiên lượng còn chưa rõ ràng. Sự quá bộc lộ này đánh giá bởi hóa mô miễn dịch.
Hai thử nghiệm pha 3 lớn BR21 và ISEL đánh giá tiên lượng điều trị erlotinib hoặc gefitinib liên quan tới sự bộc lộ EGFR. Trong thử nghiệm BR21, 325 mẫu mô u được đánh giá bộc lộ protein EGFR. Và ở bệnh nhân có bộc lộ EGFR qua hóa mô miễn dịch điều trị erlotinib có sự cải thiện sống sót đáng kể so với placebo với chỉ số HR 0.68, trong khi không có khác biệt ở nhóm EGFR IHC âm tính.
Trong thử nghiệm ISEL, nhóm EGFR IHC dương tính điều trị gefitinib có sự cải thiện sống sót đáng kể với HR 0.77. Trong thử nghiệm SATURN với erlotinib điều trị duy trì ở bệnh nhân không tiến triển sau 4 chu kỳ hóa chất có platinum, sự giảm nguy cơ tiến triển hoặc tử vong là tương đương với mọi mức độ bộc lộ EGFR.
Các dữ liệu cho thấy sự bộc lộ EGFR không phải yếu tố dự báo và tiên lượng cho sống sót hoặc sống thêm không tiến triển. Vài yếu tố có thể giải thích cho điều này và gần đây làm sáng tỏ vai trò của điều hòa EGFR. Tác giả Zhang và cộng sự cho thấy protein đa năng cảm ứng gen nguyên phân 6 (Mig6) có vai trò quan trọng trong sự tập trung tín hiệu của mạng lưới EGFR bằng cách ngăn chặn hình thành dimer hoạt hóa tương tác với phần kinase của EGFR.
Gần đây, Chang và cộng sự thấy rằng khối u không có đột biến EGFR nhạy càm với hiệu quả ức chế của erlotinib khi có tỉ lệ thấp Mig6/EGFR, điều này có thể gợi ý vai trò của sự đánh giá bộc lộ protein bằng IHC để nhận ra cá thể EGFR wild-type có thể có lợi ích điều trị thuốc đích.
b. Số bản sao gen EGFR
Cơ chế khác gây điều hòa xuôi dòng EGFR là khuếch đại gen. Khuếch đại EGFR gặp khoảng 10% số ca với thêm khoảng 20% bệnh nhân đa nhiễm sắc thể. Các nghiên cứu khác nhau đánh giá tiên lượng của số bảo sao gen EGFR xác định bằng lai tại chỗ huỳnh quang FISH và không cho thấy sự liên quan tới sống sót.
Một vài nghiên cứu đánh giá giá trị dự báo nhạy cảm với thuốc đích của số bản sao gen EGFR. Trong nghiên cứu đầu tiên, bệnh nhân có đa nhiễm sắc thể EGFR hoặc khuếch đại gen với FISH có tỉ lệ đáp ứng cao hơn đáng kể và thời gian sống thêm, thời gian tới khi tiến triển dài hơn đáng kể so với không có khuếch đại gen bởi FISH.
Bệnh nhân có EGFR FISH dương tính điều trị erlotinib có tỉ lệ sống sót, đáp ứng cao hơn so với placebo với HR 0.44, trong khi không có lợi ích ở nhóm EGFR FISH âm tính. Cập nhật kết quả xác nhận lợi ích sống sót rõ ràng ở nhóm FISH dương tính điều trị với erlotinib so với placebo.
Trong thử nghiệm ISEL, xác nhận tiên lượng tốt hơn về tỉ lệ đáp ứng và sống sót khi điều trị gefitinib ở nhóm EGFR FISH (+) so với placebo. Trong thử nghiệm ONCOBELL, đanhá giá đáp ứng với gefitinib ở bệnh nhân EGFR FISH (+), không hút thuốc đã xác nhận vai trò của test EGFR FISH sàng lọc bệnh nhân. Tỉ lệ đáp ứng cao tới 68% ở nhóm EGFR FISH(+) và không có đáp ứng ở nhóm FISH(-).
Tuy nhiên cũng có nghiên cứu gây ảnh hưởng tới test FISH. Nghiên cứu IPASS đánh giá bệnh nhân Châu Á, ung thư biểu mô tuyến không hút thuốc hoặc hút thuốc ít điều trị bước 1 với gefitinib hoặc hóa chất carboplatin/paclitaxel. Trong toàn bộ nhóm nghiên cứu, gefitinib cải thiện đáng kể thời gian sống thêm không tiến triển (PFS). PFS dài hơn đáng kể với gefitinib ở nhóm có cả tăng bản sao gen EGFR và đột biến EGFR với HR 0.48, nhưng lại ngắn hơn đáng kể ở nhóm chỉ có tăng bản sao gen EGFR mà không có đột biến EGFR, điều này chỉ ra rằng giá trị dự báo của số bản sao gen EGFR bị biến đổi bởi đột biến EGFR đồng thời.
Trong thử nghiệm SATURN, so sánh erlotinib với placebo ở nhóm bệnh nhân không tiến triển sau 4 chu kỳ hóa chất có platinum. Kết quả thấy erlotinib duy trì kéo dài đáng kể PFS và sống thêm toàn bộ (OS) với mọi đặc điểm sinh học và lâm sàng, trong đó nhóm có đột biến EGFR có PFS cao nhất. erlotinib cũng cho PFS dài hơn đáng kể ở nhóm có EGFR FISH(+) với HR 0.68 mà không có lợi ích ở nhóm FISH(-) với HR 0.81.
Tóm lại, số bản sao gen EGFR không phải marker lý tưởng để lựa chọn bệnh nhân điều trị thuốc đích.
c. Đột biến gen EGFR
Việc phát hiện ra đột biến ở miền tyrosine kinase ở phân tử protein EGFR là rất quan trọng giúp nhận ra nhóm bệnh nhân có lợi ích lâm sàng từ thuốc đích erlotinib và gefitinib. Các đột biến này là đột biến soma và hay gặp ở nhóm bệnh nhân có đặc điểm lâm sàng liên quan tới sự nhạy cảm thuốc đích như: giới nữ, ung thư biểu mô tuyến, người Châu Á và không hút thuốc.
Pham và cộng sự thấy đột biến EGFR trong ung thư biểu mô tuyến giảm cùng với sự tăng tiếp xúc khói thuốc. Đột biến ít gặp ở người hút trên 15 bao-năm hoặc người đã dừng hút thuốc dưới 25 năm.
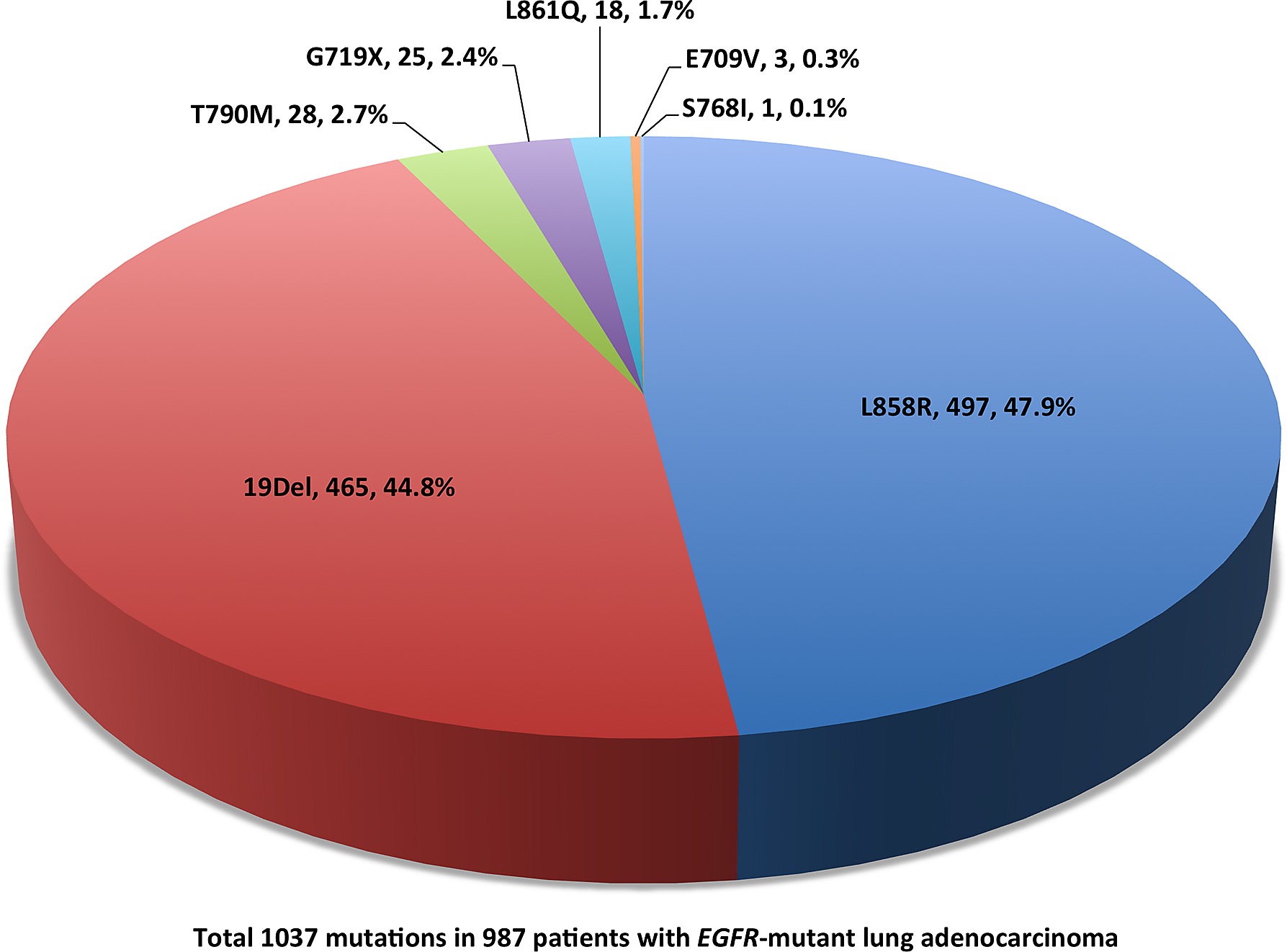
Các đột biến EGFR hay gặp nhất chiếm 85% tổng số đột biến EGFR gồm exon19del và L858R. 2 đột biến này làm tăng nhạy cảm với thuốc đích qua sự biến đổi cấu trúc quan trọng ở vùng gắn ATP của miền tyrosine kinase. Các đột biến ít gặp hơn là là cài exon19 (1%), cài exon20 (4%), đột biến điểm exon18 (G719: 3%) và exon21 (L861Q: 2%).
Các đột biến hay gặp nhất nằm trong hoặc liên quan tới vùng gắn ATP của tyrosine kinase, các đột biến ít gặp sẽ nằm ở vùng khác của miền tyrosine kinase, do đó sự đáp ứng với thuốc đích của các đột biến ít gặp sẽ khác so với đột biến truyền thống.
3. Giá trị dự báo và tiên lượng của đột biến EGFR
a. Giá trị tiên lượng của đột biến EGFR
Các nghiên cứu đã cho thấy sự cải thiện tiên lượng của đột biến EGFR độc lập với điều trị. Trong thử nghiệm BR21 so sánh erlotinib với placebo điều trị bước 2, 3 ở giai đoạn di căn; thời gian OS trung bình đạt 9.1 tháng với đột biến EGFR và 3.5 tháng với EGFR wild-type.
Nghiên cứu TRIBUTE so sánh hóa chất carboplatin/paclitaxel có hoặc không kết hợp erlotinib điều trị bước 1. Thời gian tới khi tiến triển (TTP) khác biệt đáng kể giữa nhóm có đột biến EGFR đạt 8 tháng so với 5 tháng nhóm wild-type; tương tự với OS (not reach vs 10 tháng).
Thử nghiệm INTACT 1, 2 pha 3 so sánh hóa chất có platinum có hoặc không kết hợp gefitinib điều trị bước 1. Bệnh nhân có đột biến EGFR đều có sống sót cao hơn bất kể phác đồ điều trị. Tương tự thử nghiệm INTEREST so sánh Iressa và Taxotere, OS dài hơn đáng kể ở bệnh nhân có đột biến EGFR khi điều trị với Iressa đạt 14.2 tháng hay Taxotere đạt 16.6 tháng so với wild-type đạt 6.4 và 6.6 tháng.
Để đánh giá khi nào đột biến EGFR có thể là marker dự báo cho lợi ích sống sót khi điều trị gefitinib trong ung thư biểu mô tuyến, các tác giả Nhật Bản đã cho thấy có sự kéo dài sống sót đáng kể với đột biến EGFR trước và sau khi điều trị gefitinib được chấp thuận, trong khi không có sự khác biệt ở nhóm không có đột biến EGFR. Quan trọng hơn, trước khi gefitinib được chấp thuận, nhóm có đột biến EGFR sống sót dài hơn đáng kể nhóm không đột biến. Dữ liệu này cho thấy đột biến EGFR đáng kể dự báo cả lợi ích sống sót của gefitinib và tiên lượng tốt ở bệnh nhân ung thư biểu mô tuyến.
Nghiên cứu gần đây gợi ý sự có mặt đột biến T790M trong mẫu u trước hoặc sau khi tiếp xúc thuốc đích có tiên lượng tốt. Ít nhất 50% ca kháng thuốc mắc phải là do T790M, đột biến thứ phát ở exon20. T790M được cho là giảm hiệu quả thuốc đích và đôi khi gặp ở bệnh nhân chưa điều trị đích. Oxnard và cộng sự phân tích 93 bệnh nhân đột biến EGFR có T790M thứ phát ở mẫu u khi thất bại thuốc đích. Thú vị là bệnh nhân có T790M có OS dài hơn đáng kể T790M(-), chỉ ra rằng T790M xác định nhóm lâm sàng có tiên lượng tốt tiến triển nhẹ hơn. Rosell và cộng sự phân tích tiên lượng bệnh nhân có đột biến EGFR trong nghiên cứu EURTAC so sánh erlotinib và hóa chất platinum ở bệnh nhân di căn chưa điều trị. Bệnh nhân có T790M có sống sót dài hơn bất kể phác đồ điều trị, nhấn mạnh giả thiết rằng T790M có tiên lượng tốt.
Ngược lại, vai trò của đột biến EGFR ở giai đoạn sớm chưa được xác nhận. 3 thử nghiệm ở Châu Á cho thấy đột biến EGFR không độc lập dự báo sống sót ở giai đoạn sớm đã phẫu thuật.
b. Đột biến EGFR và nhạy cảm với hóa chất
Giá trị dự báo của đột biến EGFR với hóa chất là chưa rõ ràng. Một phân tích hồi cứu ở bệnh nhân Đông Á điều trị hóa chất, đột biến EGFR không cải thiện sống sót so với wild-type mặc dù có sự đáp ứng cao hơn nhưng không có giá trị thống kê.
Năm 2007, một phân tích 190 bệnh nhân với mục đích làm sáng tỏ khi nào sự bộc lộ EGFR, số bản sao gen hoặc đột biến có thể dự báo nhạy cảm với hóa chất ở giai đoạn di căn. Phân tích hồi cứu này cho thấy không có sự liên quan giữa đáp ứng xuôi dòng EGFR với đáp ứng hóa chất.
Trong nghiên cứu IPASS, tỉ lệ đáp ứng cao hơn đáng kể thấy ở nhóm đột biến EGFR. Trong nghiên cứu INTEREST, tỉ lệ đáp ứng ấn tượng 21% ở nhóm đột biến EGFR điều trị bước 2 docetaxel. Trong thử nghiệm bổ trợ JBR10, lợi ích sống sót có xu hướng nhưng không đáng kể khi bổ trợ cisplatin/vinorelbine ở nhóm đột biến exon19del và L858R. Do đó, theo các dữ liệu, có thể đột biến EGFR có độ nhạy cao hơn với hóa chất chuẩn.




