VAI TRÒ CỦA ĐỘT BIẾN EGFR TRONG UNG THƯ PHỔI
15:13 - 06/05/2023
Mô tả đặc điểm đột biến EGFR, cơ chế sinh ung thư và các thuốc đích điều trị tương ứng
So sánh thời gian sống không tiến triển trong ung thư phổi giai đoạn 4: phác đồ nào giữ bệnh đứng yên lâu nhất?
Chọn đúng thuốc – Cơ hội sống dài hơn cho bệnh nhân ung thư phổi giai đoạn 4
Chọn đúng thuốc ung thư phổi giai đoạn 4 để sống lâu hơn
Các loại vắc xin điều trị ung thư: cơ chế, hiệu quả, hướng điều trị tiếp theo
VAI TRÒ CỦA ĐỘT BIẾN GEN EGFR TRONG UNG THƯ PHỔI
1. Tổng quan
Thuốc đích ra đời cùng với sự khám phá ra đột biến gen EGFR hay gặp trong ung thư phổi đã mang lại cuộc cách mạng trong cải thiện tiên lượng bệnh ung thư phổi giai đoạn muộn. Đột biến EGFR gồm các đột biến hay gặp gồm exon19del và L858R và một số đột biến ít gặp không điển hình.
Các con đường tín hiệu tế bào bất thường gây ra bởi đột biến EGFR dẫn tới sự phát triển không kiểm soát, ức chế sư chết tế bào theo chương trình và di căn ung thư phổi: RAS/MAPK, PI3K/AKT. Các tín hiệu tế bào này tăng khả năng di căn do sự phá vỡ vật chất ngoại bào và tăng sinh mạch máu nuôi khối u.
2. Cấu trúc phân tử EGFR
Protein EGFR có bốn vùng chức năng. Các chất gắn của EGFR bao gồm các đích phân tử có ái lực cao như EGF, yếu tố tăng trưởng biến đổi-alpha (TGFA), yếu tố tăng trưởng giống EGF gắn với heparin (HBEGF), betacellulin (BTC) và các chất gắn có ái lực thấp như amphregulin (ARG) , epiregulin (EPR) và epigen (EGN).
Các thành phần khác nhau của EGFR là a) vùng ngoại bào, b) vùng cận màng ngoại bào (eJM), c) vùng xuyên màng d) miền cận màng nội bào (iJM), e) vùng tyrosine kinase và f) đuôi tận cùng carboxy.
a. Vùng ngoại bào: gồm bốn vùng. Vùng I và III chịu trách nhiệm liên kết chất gắn và vùng II chịu trách nhiệm nhị trùng hóa. Ở dạng không hoạt động, vùng II được gấp lại nằm trên vùng IV bằng các liên kết disulfua, dẫn tới một hình thể trói buộc tự động ngăn chặn quá trình nhị trùng hóa. Liên kết với chất gắn dẫn đến sự lộ ra của nhánh nhị trùng hóa của vùng II (hình thể trói buộc thay đổi thành hình thể mở rộng). Sự nhị trùng ở vùng II dẫn đến sự sắp xếp lại trong các vùng xuyên màng, vùng kề màng nội bào và vùng kinase.
b. Vùng xuyên màng: được tạo thành từ 23 axit amin và chịu trách nhiệm neo giữ receptor vào màng tế bào. Vùng này được giả thuyết đóng vai trò trong quá trình nhị trùng hóa và có vai trò trong sự sắp xếp thẳng hàng các vùng nội bào trong quá trình xoắn quay.
c. Vùng nội bào: gồm 542 acid amin gồm vùng gần màng tế bào, vùng tyrosine kinase và đuôi tận cùng C. Vùng kinase gồm các vòng N và C phân chia bởi khe liên kết adenosine triphosphate (ATP). Vòng hoạt hóa (A-loop) được tạo bởi thùy C xoắn alpha. Ở trạng thái không hoạt động, vòng quay ra ngoài của chuỗi xoắn alpha C được ổn định bằng vòng xoắn ốc của vòng A. Điều này lần lượt ngăn chặn sự tương tác giữa K745 và E762, cả hai đều nằm trong vòng N và chịu trách nhiệm liên kết và định hướng ATP bằng cách hình thành liên kết với các phosphat alpha và beta. Đuôi C chứa phần dư tyrosine. Sự phosphoryl hóa các gốc này cho phép gắn các protein nội bào khác nhau vào thụ thể cho phép truyền tín hiệu.
3. Con đường tín hiệu sau khi hoạt hóa EGFR
Các con đường tín hiệu xuôi dòng của EGFR gồm:
a. Con đường RAS-RAF-MEK-ERK-MAPK: khi hoạt hóa bởi EGF, tín hiệu EGFR phát triển qua chu kỳ tế bào G1/S. Sự phosphoryl hóa vùng tận cùng C tích lũy các protein gắn yếu tố phát triển 2 (GRB-2) và và chất tương đồng Src và collagen (SHC). Chúng liên kết với SOS1 (Son of Sevenless 1), hoạt động như một yếu tố trao đổi nucleotide guanine cho RAS GTPase. Nó hoạt động bằng cách kích hoạt RAS. RAS tương tác với vùng chất gắn liên kết RAF1 RAS GTP (RBD). RAF1 phosphoryl hóa phần dư serine đặc hiệu của MEK-1/2 (protein kinase được hoạt hóa bằng mitogen, MAPKK), từ đó kích hoạt ERK1/2, sau đó tạo ra các con đường phản ứng sinh học khác nhau.
b. Con đường PI3K-AKT-mTOR: chất phosphatidyl inositol 3 kinase gồm 3 lớp (I, II, III) dựa trên cấu trúc, cấu trúc dưới lớp và cơ chế điều hòa. Class I là yếu tố hiệu quả xuôi dòng của EGFR. PI3K phosphoryl hóa nhóm hydroxyl của phân tử phosphatidyl inositol 4,5 biphosphate (PIP2) màng tế bào để tạo ra phosphatidyl inosito 3,4,5 triphosphate (PIP3) là chất gây chuyển vị AKT (protein kinase B) tới màng tế bào. AKT có khả năng kích thích phân tử mTOR gây tăng tổng hợp cyclin D1, yếu tố thiếu oxy mô 1 (HIF1) và yếu tố phát triển nội mạc (VEGF); và thành phần của mTOR đặc biệt là TORC1 không chỉ kích thích các con đường đồng hóa tế bào như tổng hợp ribosome, nucleotide và lipid mà còn ngăn chặn quá trình dị hóa.
c. Con đường PLC-gamma 1-PKC: chất phospholipase C (PLC) gamma 1 có thể gắn trực tiếp vào EGFR hoạt hóa hoặc được tích tũy tới màng tế bào bởi PIP3. PLC tích lũy có thể thủy phân PIP3 thành triphosphat nội bào tự do (IP3) và diacylglycerol (DAG) là chất truyền tin thứ cấp. IP3 sau đó gắn vào lưới nội bào có hạt để giải phóng calci. Cả DAG và calci đều là chất hoạt hóa protein kinase C (PKC). PLC gamma là thành phần xuôi dòng của các tín hiệu VEGF, EGF và yếu tố phát triển tiểu cầu (PDGF), và có vai trò quan trọng trong sự phát triển, biệt hóa tế bào, vận chuyển calci.
Hoạt hóa nhân tế bào bởi EGFR: trong nhân tế bào, EGFR có vai trò điều hòa sao chép, giúp quá trình sao chép nhiều yếu tố trung gian chu kỳ tế bào như cyclin D1 và cMYC, làm trung gian cho vai trò quan trọng của việc truyền tín hiệu EGFR trong cơ chế bệnh sinh ung thư. Cùng với sự kích thích của EGF, H2O2, kích thích tia cực tím và bức xạ ion hóa có thể dẫn đến sự chuyển vị trí của EGFR tới nhân. EGFR hạt nhân đã được chứng minh là có liên quan đến vùng khởi động của Cyclin D1, do đó đóng vai trò trong sự tăng sinh tế bào.
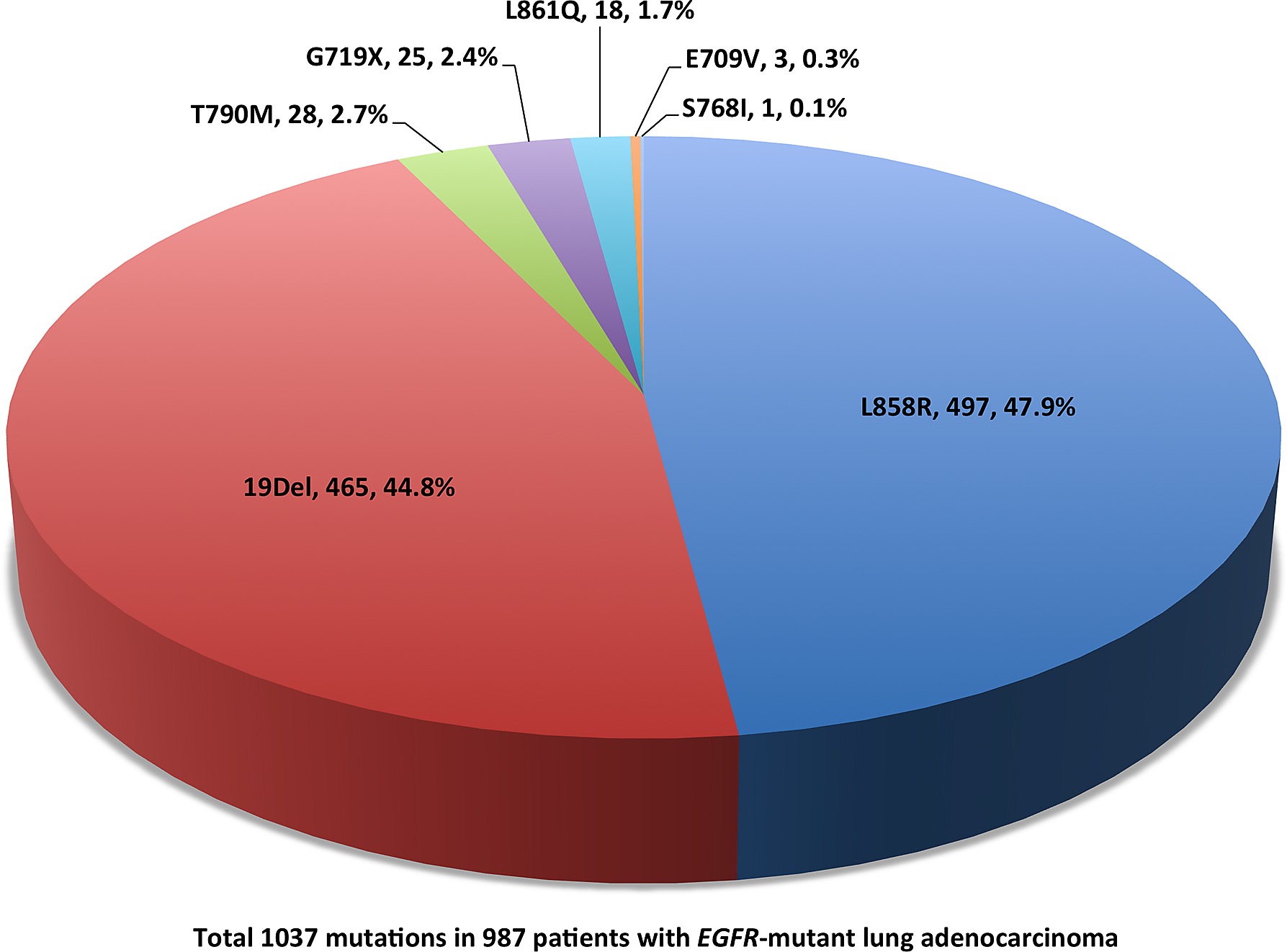
4. Các đột biến EGFR hay gặp
Hai loại đột biến EGFR hay gặp nhất trong ung thư phổi không tế bào nhỏ gồm đột biến exon19del (tỉ lệ 44-51%) và L858R (tỉ lệ 38-40%), 2 loại đột biến này chiếm tới 90% các đột biến EGFR trong ung thư phổi.
5. Các đột biến EGFR ít gặp
Khoảng 7-23% ung thư phổi không tế bào nhỏ gặp đột biến EGFR ít gặp với khả năng nhạy cảm khác nhau với thuốc đích. Hay gặp nhất là đột biến exon20ins chiếm 6% sau đó là các đột biến điểm như G719X, L861Q, S768I và exon19ins.
6. Điều trị ung thư phổi có đột biến EGFR
Đột biến EGFR có ý nghĩa mang lại sự nhạy cảm cao với các thế hệ thuốc đích tương ứng. Thuốc đích có thể dùng đơn độc hoặc kết hợp với các thuốc khác.
a. Thuốc đích thế hệ 1 và 2
Gefitinib là thuốc đích đầu tiên được thử nghiệm điều trị đột biến EGFR và hiệu quả vượt trội đã được chứng minh so với hóa chất khi đạt thời gian sống thêm không tiến triển vượt trội đạt 9,5 tháng so với 6,3 tháng hóa chất.
Erlotinib là thuốc đích thế hệ 2 thứ hai được chấp thuận điều trị đột biến EGFR, so với hóa chất, thời gian sống không tiến triển với erlotinib cao hơn đạt 13,1 tháng so với 4,6 tháng hóa chất, tỉ lệ đáp ứng cao hơn đạt 83% vs 36% hóa chất và thời gian sống thêm tương đương khoảng 22,8-27,2 tháng.
Afatinib là thuốc đích thế hệ 2 được chấp thuận điều trị đột biến EGFR, so với hóa chất, afatinib cho thời gian sống không tiến triển cao hơn đạt 11,1 tháng vs 6,9 tháng hóa chất, tỉ lệ đáp ứng cao hơn đạt 56% vs 23% hóa chất và thời gian sống thêm tương đương khoảng 28 tháng. Đặc biệt với đột biến exon19del nhạy cảm, thời gian sống thêm đạt tới 33,3 tháng.
Các nghiên cứu cho thấy afatinib đặc biệt hiệu quả với đột biến exon19del với thời gian sống thêm đều >30 tháng, afatinib còn hiệu quả với đột biến ít gặp: G719X, L861Q, S768I.

b. Thuốc đích thế hệ 3 osimertinib
Osimertinib là thuốc đích thế hệ 3 được chấp thuận điều trị rộng rãi nhất ở giai đoạn muộn di căn cả với bước 1 và bước sau. Trong điều trị bước 1, osimertinib cho tỉ lệ đáp ứng cao tới 80%, thời gian sống thêm không tiến triển tới 18,2 tháng, thời gian sống thêm đạt 38,6 tháng, vượt trội hóa chất cũng như thuốc đích thế hệ 1.
Trong điều trị bước sau, osimertinib cũng cho hiệu quả vượt trội so với hóa chất khi thời gian sống thêm không tiến triển dài hơn đạt 10,1 tháng vs 4,4 tháng hóa chất.
c. Vai trò của osimertinib với di căn não
Đối với di căn não, osimertinib cũng cho hiệu quả điều trị vượt trội do khả năng thấm tốt vào hệ thần kinh, giúp thuyên giảm bệnh tới 91% vs 68% thuốc đích thế hệ 1; so với hóa chất, osimertinib cũng cho thời gian kiểm soát tổn thương sọ não cao hơn đạt 11,7 tháng vs 5,6 tháng hóa chất.
Di căn màng não là tình trạng nặng ít gặp của di căn sọ não bởi ung thư phổi. Osimertinib giúp kiểm soát tốt di căn màng não với tỉ lệ đáp ứng khoảng 55-62%, thời gian không tiến triển trung bình 11 tháng và thời gian sống thêm trung bình 15,2-18,8 tháng.
d. Thuốc đích điều trị ung thư phổi giai đoạn sớm sau mổ
Một số nghiên cứu cho thấy gefitinib và erlotinib điều trị sau mổ ở giai đoạn sớm 2-3A giúp cải thiện tỉ lệ sống không bệnh 2 năm so với hóa chất, thời gian sống thêm toàn bộ có xu hướng cao hơn hóa chất.
Osimertinib là thuốc đích được chấp thuận điều trị bổ trợ sau mổ nếu có đột biến nhạy cảm gồm exon19del và L858R. Tỉ lệ sống 2 năm không bệnh ở giai đoạn 2-3A với osimertinib đạt 90% vs 44% nhóm giả dược. Lợi ích osimertinib tốt ở nhóm sau mổ R1, R2. Với giai đoạn 1B vai trò của osimertinib ít hơn so với giai đoạn 2-3A. Lợi ích của osimertinib rõ nhất ở giai đoạn 3A với tỉ lệ sống không bệnh 2 năm tới 88% so với chỉ 32% nhóm giả dược.
e. Kết hợp thuốc đích với các phương pháp khác: kháng tăng sinh mạch, hóa chất
Các thử nghiệm kết hợp thuốc đích thế hệ 1 erlotinib với thuốc kháng sinh mạch bevacizumab đã cho hiệu quả hơn so với thuốc đích erlotinib đơn thuần với thời gian không tiến triển dài hơn đạt 16 tháng vs 9-13 tháng erlotinib đơn thuần. Thời gian sống trung bình cũng dài hơn ở nhóm erlotinib+bevacizumab đạt 50,7 tháng so với 46,2 tháng erlotinib.
Kết hợp thuốc đích erlotinib và thuốc kháng sinh mạch bevacizumab được chấp thuận điều trị cho nhóm ung thư phổi không phải tế bào vảy ở giai đoạn muộn.
Kết hợp erlotinib với thuốc kháng sinh mạch ramucirumab cũng được chấp thuận điều trị ở nhóm không phải tế bào vảy do hiệu quả thời gian sống thêm không tiến triển cao hơn đạt 19,4 tháng vs 12,4 tháng erlotinib đơn thuần.
Khi kết hợp hóa chất, thuốc đích cho thấy hiệu quả hơn so với thuốc đích đơn thuần khi kéo dài hơn thời gian sống thêm không tiến triển khoảng 17-20 tháng so với 8-11 tháng thuốc đích đơn thuần, nhưng thời gian sống thêm toàn bộ chưa có khác biệt và cần thận trọng với độc tính khi kết hợp thuốc đích và hóa chất.
Như vậy thuốc đích với đột biến EGFR nhạy cảm có vai trò quan trọng giúp cải thiện tiên lượng bệnh và thời gian sống thêm không chỉ ở giai đoạn muộn mà còn cả ở giai đoạn sớm sau mổ. Thuốc đích có thể hiệu quả khi điều trị đơn thuần hoặc kết hợp thuốc khác
TÀI LIỆU THAM KHẢO
- Sharma, Mansi; Basu, Dharmishtha A.; Nathany, Shrinidhi1; Amrith, B. P.; Batra, Ullas. A narrative review of the role of common EGFR mutations in pathogenesis and treatment of non-small-cell lung carcinoma. Cancer Research, Statistics, and Treatment 5(3):p 507-518, Jul–Sep 2022. | DOI: 10.4103/crst.crst_222_22
- Ettinger DS, Wood DE, Aisner DL, et al. Non-Small Cell Lung Cancer, Version 3.2023, NCCN Clinical Practice Guidelines in Oncology. 2023(1540-1413 (Electronic)).
Để biết thêm chi tiết xin liên hệ:
- Ths. Bs. Trần Khôi - Bệnh viện Phổi Hà Nội
- 44 Thanh Nhàn, Hai Bà Trưng, Hà Nội
- Hotline: 0983 812 084, 0913 058 294
- CHỮA BỆNH UNG THƯ PHỔI: https://www.facebook.com/groups/894940984347355
- Youtube: https://www.youtube.com/channel/UCjueL8VycYzFjGkVcglHV2g




