Đột biến gen KRAS G12C, cơ chế sinh ung thư và chiến lược điều trị
10:56 - 07/05/2025
Tìm hiểu vai trò của đột biến KRAS G12C trong ung thư phổi không tế bào nhỏ (UTPKTBN): cơ chế sinh ung thư, đặc điểm dịch tễ, thuốc điều trị trúng đích và thách thức kháng thuốc hiện nay.
So sánh thời gian sống không tiến triển trong ung thư phổi giai đoạn 4: phác đồ nào giữ bệnh đứng yên lâu nhất?
Chọn đúng thuốc – Cơ hội sống dài hơn cho bệnh nhân ung thư phổi giai đoạn 4
Chọn đúng thuốc ung thư phổi giai đoạn 4 để sống lâu hơn
Các loại vắc xin điều trị ung thư: cơ chế, hiệu quả, hướng điều trị tiếp theo
Đột biến gen và cơ chế sinh ung thư của KRAS G12C
I. Giới thiệu
Ung thư phổi là một trong những nguyên nhân gây tử vong hàng đầu trên toàn thế giới, với ung thư phổi không tế bào nhỏ (UTPKTBN) chiếm khoảng 85% tổng số ca mắc. Trong số các biến đổi di truyền được phát hiện trong UTPKTBN, đột biến gen KRAS (Kirsten rat sarcoma viral oncogene homolog) là một trong những đột biến phổ biến và có liên quan chặt chẽ đến quá trình sinh ung thư. Trong đó, KRAS G12C là một biến thể đột biến tại codon 12 được nghiên cứu nhiều nhất hiện nay, chiếm khoảng 13–15% số bệnh nhân UTPKTBN tại Hoa Kỳ và chiếm đến ~39% trong tổng số các đột biến KRAS ở UTPKTBN.
Đáng chú ý, KRAS G12C có đặc điểm dịch tễ học cụ thể:
Xuất hiện phổ biến hơn ở người da trắng và người Mỹ gốc Phi so với người châu Á.
Ở người da trắng, tỉ lệ KRAS G12C cao hơn ở nữ giới, trong khi ở người châu Á, nam giới có tỉ lệ cao hơn.
Mạnh mẽ liên quan đến tiền sử hút thuốc, đặc biệt là người hút thuốc lá lâu năm.
Chiếm từ 11–15% các trường hợp UTPKTBN nói chung và lên đến gần 40% trong số các bệnh nhân UTPKTBN có đột biến KRAS.
KRAS từng được coi là một “mục tiêu không thể nhắm đến” (undruggable target) trong hàng thập kỷ do cấu trúc bề mặt trơn và không có túi liên kết rõ ràng cho thuốc. Tuy nhiên, sự xuất hiện của KRAS G12C đã mở ra một thời kỳ mới trong điều trị nhắm trúng đích nhờ cấu trúc đặc biệt tạo ra một “túi ẩn” có thể liên kết thuốc.
II. Họ gen RAS và vai trò sinh học
1. Họ gen RAS là gì?
Họ gen RAS là một nhóm gen quan trọng và bảo tồn cao trong tiến hóa, mã hóa cho các protein GTPase nhỏ có vai trò như công tắc phân tử trong truyền tín hiệu nội bào. Những gen này đóng vai trò trung tâm trong việc kiểm soát tăng sinh, biệt hóa, sống sót và di chuyển của tế bào.
2. Truyền tín hiệu nội bào (Signal Transduction)
RAS là "cầu nối" giữa thụ thể trên màng tế bào (như EGFR) và các đường truyền tín hiệu nội bào như:
MAPK/ERK pathway
PI3K/AKT pathway
Ral-GDS pathway
Các con đường này điều hòa tăng trưởng, phân bào, sống sót và biệt hóa tế bào.
3. Vai trò như “công tắc phân tử” (Molecular switch)
RAS chuyển qua lại giữa:
Trạng thái hoạt động (gắn GTP)
Trạng thái không hoạt động (gắn GDP)
Quá trình này được điều khiển bởi:
GEFs: trao đổi GDP lấy GTP (kích hoạt)
GAPs: thúc đẩy thủy phân GTP thành GDP (bất hoạt)
Cơ chế này cho phép tế bào phản ứng linh hoạt với các tín hiệu môi trường.
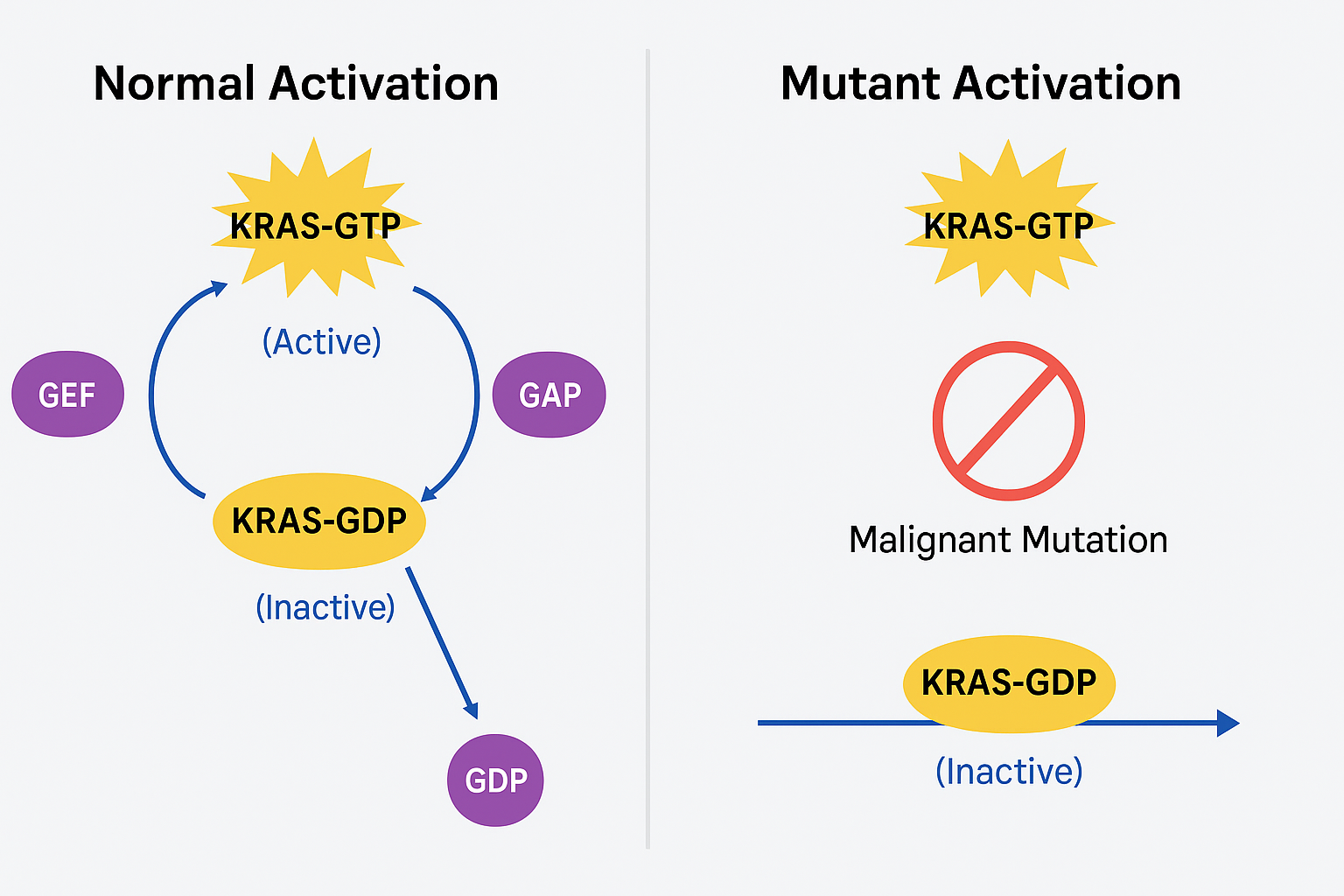
4. Ý nghĩa trong ung thư học
Khi RAS bị đột biến (nhất là KRAS, HRAS, NRAS), protein RAS mất khả năng thủy phân GTP, luôn ở trạng thái “bật” và kích hoạt liên tục các đường tín hiệu sinh ung thư. Đột biến RAS liên quan đến nhiều loại ung thư như:
Ung thư phổi (KRAS)
Ung thư đại trực tràng (KRAS, NRAS)
Ung thư tuyến giáp, bàng quang, tụy...
5. Ý nghĩa trong điều trị
Trước đây RAS được xem là mục tiêu “không thể nhắm trúng” vì thiếu vị trí liên kết thuốc. Tuy nhiên, đột biến như KRAS G12C đã mở ra khả năng thiết kế thuốc nhắm trúng đích (ví dụ: Sotorasib, Adagrasib).
6. Các thành viên chính trong họ RAS
| Gen | Vị trí NST | Phổ ung thư liên quan |
|---|---|---|
| HRAS | 11p15 | Da, bàng quang, tuyến giáp |
| KRAS | 12p12 | Phổi, tụy, đại tràng |
| NRAS | 1p13 | Huyết học (bạch cầu), hắc tố |
III. Cơ chế sinh ung thư của KRAS G12C
1. Đột biến G12C và hậu quả chức năng
KRAS G12C là đột biến thay thế glycine (G) tại vị trí codon 12 thành cysteine (C). Sự thay đổi này làm mất đi khả năng tương tác hiệu quả với GAPs, khiến KRAS:
Duy trì lâu hơn ở trạng thái hoạt động (GTP-bound)
Không thể “tắt công tắc” truyền tín hiệu
Kích hoạt liên tục các tín hiệu tăng sinh tế bào, chống chết tế bào, dẫn đến sinh ung thư
2. Sự khác biệt của G12C với các đột biến KRAS khác
KRAS G12C vẫn giữ được hoạt tính GTPase tương tự KRAS hoang dã, điều này cho phép một số loại thuốc liên kết cộng hóa trị vào cysteine đặc hiệu, từ đó giữ KRAS ở trạng thái GDP-bound và ngăn hoạt hóa downstream như RAF/MEK/ERK.
3. Tác động đến vi môi trường u (TME)
KRAS G12C còn góp phần tạo nên môi trường miễn dịch ức chế thông qua:
Tăng biểu hiện PD-L1
Tiết cytokine IL-10 và TGF-β → tăng Treg, giảm hoạt tính T CD8+
Giảm xâm nhập của tế bào miễn dịch hiệu ứng
Gây biệt hóa nguyên bào sợi ung thư (CAF) → duy trì trạng thái viêm mãn tính thúc đẩy u phát triển
IV. Sự phát triển của thuốc ức chế KRAS G12C
1. Nguyên lý hoạt động
Các thuốc thế hệ mới nhắm vào KRAS G12C hoạt động bằng cách:
Gắn kết cộng hóa trị vào cysteine tại vị trí G12
Ổn định trạng thái KRAS-GDP (không hoạt động)
Ngăn KRAS tương tác với RAF → ngắt dòng MAPK signaling
2. Các thuốc nổi bật
a. AMG 510 (Sotorasib)
Thuốc đầu tiên được FDA phê duyệt năm 2021
ORR ~41%, DCR ~84%, PFS ~6.3 tháng
Nhược điểm: không cải thiện OS rõ rệt trong CodeBreaK 200
b. MRTX849 (Adagrasib)
FDA phê duyệt 2022
ORR cao hơn, tốt hơn trên bệnh nhân có di căn não
PFS ~6.9 tháng, OS ~14.1 tháng
c. Các thuốc mới hơn
D-1553 (Garsorasib): hiệu quả cao, ORR 50%, PFS 7.56 tháng
JAB-21822 (Glecirasib), IBI351 (GFH925), JDQ443, LY3537982 – đều trong thử nghiệm giai đoạn 1–3
V. Cơ chế kháng thuốc KRAS G12C
1. Đột biến thứ cấp (Secondary mutations)
Y96D/S, Q99L: gây mất hiệu lực liên kết thuốc vào Switch II pocket
2. Hoạt hóa đường dẫn bù (Bypass pathways)
EGFR/MET/RET amplification → kích hoạt lại MAPK/AKT/STAT
Co-mutations như STK11, KEAP1, TP53 → giảm đáp ứng với ức chế đơn độc
3. EMT và chuyển dạng mô học
KRAS G12C kết hợp STK11 có thể thúc đẩy chuyển dạng u tuyến → tế bào vảy
Gây kháng thuốc bẩm sinh hoặc mắc phải
VI. Triển vọng liệu pháp kết hợp
Các hướng kết hợp hiện được nghiên cứu:
KRAS G12C + ức chế miễn dịch (PD-1/PD-L1)
KRAS G12C + SHP2 inhibitors
KRAS G12C + MEK inhibitors
KRAS G12C + EGFR antibodies (cetuximab)
Mục tiêu: vượt qua kháng thuốc, kéo dài đáp ứng và cải thiện chất lượng sống.
VII. Kết luận
KRAS G12C là một bước ngoặt khoa học và y học trong việc nhắm trúng đích ung thư từng được xem là “không thể nhắm đến”. Sự phát triển của các thuốc ức chế KRAS G12C như sotorasib, adagrasib, và các hợp chất mới hứa hẹn cải thiện đáng kể tiên lượng cho bệnh nhân UTPKTBN mang đột biến này.
Tuy nhiên, sự xuất hiện của kháng thuốc và biến đổi vi môi trường u đang đặt ra yêu cầu cá thể hóa điều trị, liệu pháp kết hợp, và tiếp tục nghiên cứu cơ chế sinh học sâu hơn của KRAS trong bối cảnh miễn dịch và đột biến đồng phát.
Cần tư vấn chuyên sâu về các thuốc điều trị ung thư phổi:
- ThS – BS Trần Khôi
- Bệnh viện Phổi Hà Nội – 44 Thanh Nhàn, Hai Bà Trưng
- Zalo: 0983 812 084 – Hotline: 0913 058 294
- Facebook: Bác sĩ Trần Khôi
- Kênh YouTube: Thạc sĩ Bác sĩ Trần Khôi – Chữa bệnh ung thư phổi




