CẬP NHẬT ĐIỀU TRỊ UNG THƯ PHỔI TẾ BÀO NHỎ
23:06 - 29/12/2022
Cập nhật điều trị ung thư phổi tế bào nhỏ năm 2022 và các hướng nghiên cứu mới trong điều trị thể bệnh ung thư phổi tế bào nhỏ.
So sánh thời gian sống không tiến triển trong ung thư phổi giai đoạn 4: phác đồ nào giữ bệnh đứng yên lâu nhất?
Chọn đúng thuốc – Cơ hội sống dài hơn cho bệnh nhân ung thư phổi giai đoạn 4
Chọn đúng thuốc ung thư phổi giai đoạn 4 để sống lâu hơn
Các loại vắc xin điều trị ung thư: cơ chế, hiệu quả, hướng điều trị tiếp theo
CẬP NHẬT ĐIỀU TRỊ UNG THƯ PHỔI TẾ BÀO NHỎ VÀ CÁC HƯỚNG NGHIÊN CỨU MỚI
Ung thư phổi tế bào nhỏ chiếm khoảng 15% trong ung thư phổi, và tỉ lệ này ngày càng giảm theo sự giảm tỉ lệ hút thuốc lá.
Ung thư phổi tế bào nhỏ là dạng bệnh ung thư tiến triển nhanh với khoảng 80-85% trường hợp bệnh ở giai đoạn lan tràn khi được chẩn đoán. Khoảng 10-25% bệnh nhân có di căn não khi chẩn đoán và đến 40-50% sẽ xuất hiện di căn não trong quá trình điều trị.
Tỷ lệ đáp ứng tổng thể (ORR) ≥50% đối với platinum-etoposide bước 1 rất ấn tượng nhưng hiệu quả chỉ thoáng qua vì thời gian sống trung bình là khoảng 1 năm hoặc ít hơn và thời gian sống không tiến triển ở bước 1 ngay cả sau khi bổ sung thuốc ức chế PD-L1 hầu như không quá 5 tháng. Tỷ lệ đáp ứng với liệu pháp ức chế topoisomerase I bước hai như topotecan dưới 20%. Tuy rằng đáp ứng tốt với hóa chất nhưng nhanh chóng sau đó có sự kháng thuốc dẫn tới sự giảm đáng kể số bệnh nhân điều trị tiếp bước 2 khoảng 50% và bước 3 khoảng 22%.
Bước ngoặt điều trị vào năm 2018 với thuốc miễn dịch nivolumab với tiền đề là gánh nặng khối u (TMB) cao do tiền sử hút thuốc lá dẫn tới tăng đáp ứng với liệu pháp miễn dịch. Một số hội chứng cận ung thư và sự mất chức năng của 2 gen ức chế u RB1, TP53 cũng có thể cải thiện đáp ứng miễn dịch qua sự mất ổn định di truyền.
Các thuốc tiếp theo được phê duyệt gồm Pembrolizumab, Atezolizumab năm 2019 và durvalumab năm 2020 và gia tăng chấp thuận cho lurbinectedin. Năm 2021 FDA rút bỏ chấp thuận 2 thuốc Pembrolizumab và Nivolumab và còn 6 phác đồ điều trị hiện nay: bộ đôi platinum, topotecan, Atezolizumab, durvalumab, lurbinectedin, trilaciclib.
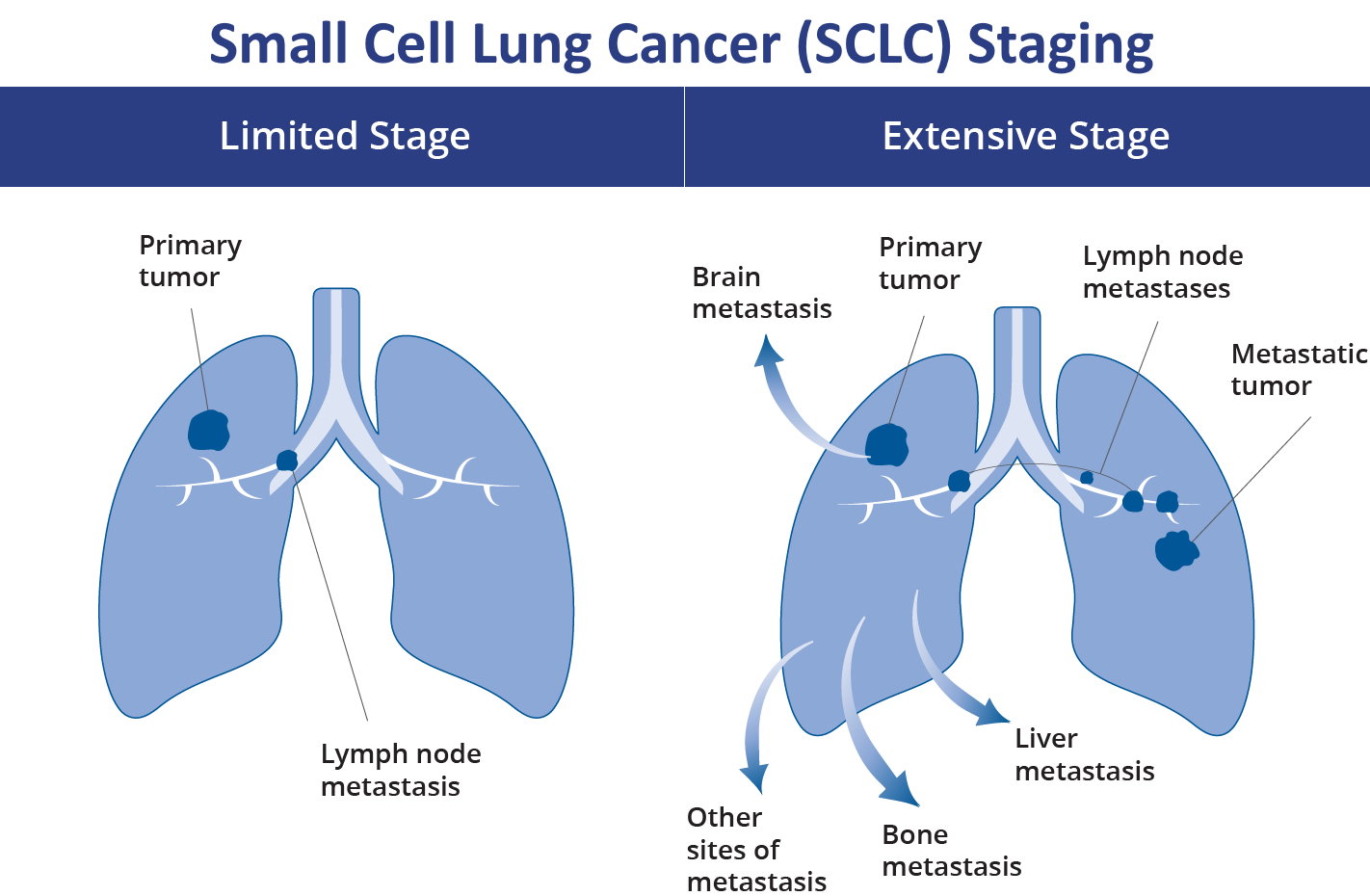
1. Phân loại TNM
Ung thư phổi tế bào nhỏ điển hình chia thành 2 giai đoạn: khu trú và lan tràn, với giai đoạn khu trú khi bệnh còn giới hạn trong một nửa lồng ngực và nằm trọn trong một trường chiếu xạ trị. Theo phân loại TNM thì giai đoạn khu trú gồm các khối u T bất kỳ (trừ T3-4 mà khối u vượt quá 1 trường chiếu xạ) bất kỳ N và M0 (chưa di căn xa). Giai đoạn lan tràn gồm bất kỳ khối u T, bất kỳ N và M1a, b.
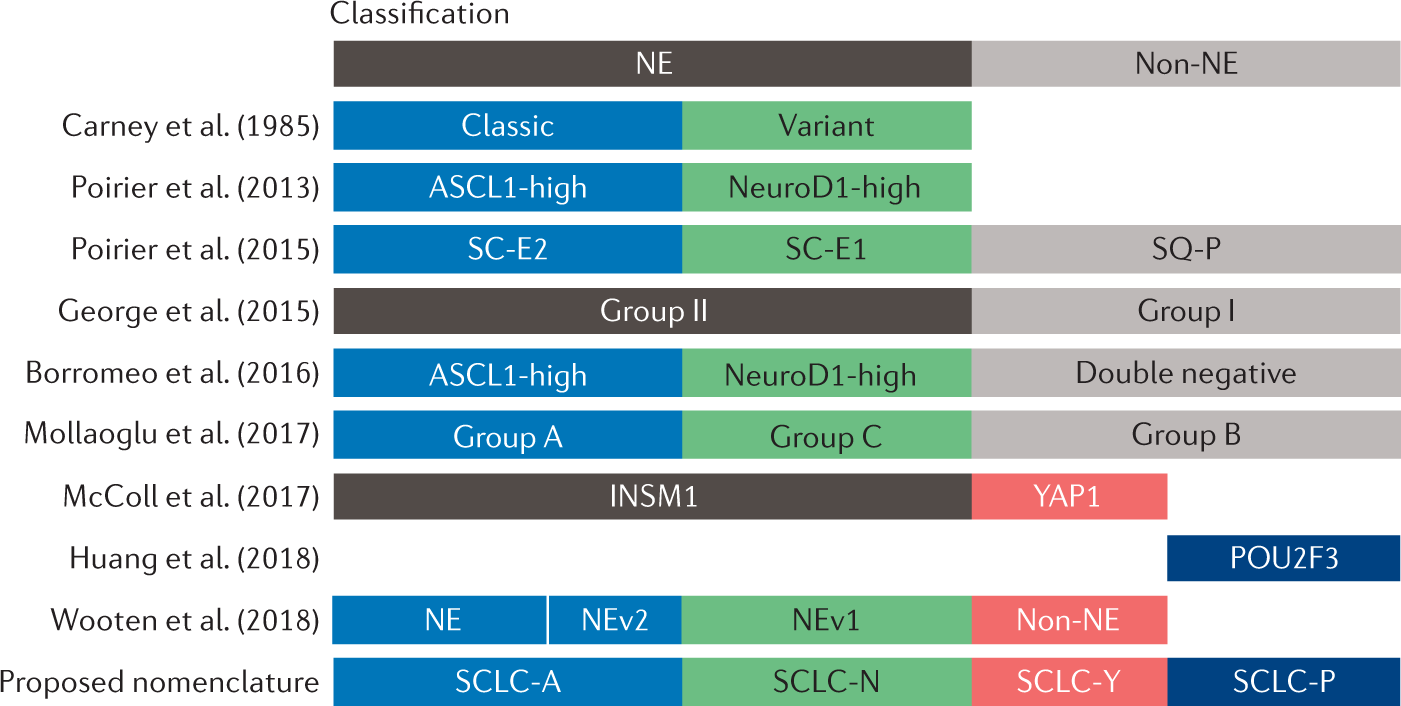
2. Phân loại phân tử và khả năng nhạy cảm điều trị
Theo tiến bộ hóa mô miễn dịch, ung thư phổi tế bào nhỏ gồm nhiều dưới nhóm có sự nhạy cảm điều trị khác nhau dựa trên sự bộc lộ yếu tố sao chép.
Dưới nhóm cổ điển hay SCLC-A là dạng hay gặp nhất có sự hoạt hóa yếu tố sao chép ASCL1 chiếm khoảng 40-50% trường hợp. Dưới nhóm SCLC-N hoạt hóa yếu tố NEUROD1 gặp khoảng 25-30%, có sự kháng hóa chất platinum nhưng nhạy cảm với chất ức chế phản ứng tổn thương DNA (vd: chất ức chế poly (ADP-ribose) polymerase (PARP)).
Dưới nhóm không phải thần kinh nội tiết SCLC-P hoạt hóa yếu tố POU2F3 gặp khoảng 7-16% ca bệnh, dưới nhóm này nhạy cảm với platinum và chất ức chế PARP. Dưới nhóm SCLC-I hoạt hóa yếu tố YAP-1 gặp khoảng 15% thường kháng platinum, dưới nhóm này có đặc tính miễn dịch nên có khả năng nhạy cảm với thuốc ức chế điểm miễn dịch.
3. Điều trị bước 1
Trước khi có thuốc miễn dịch, điều trị chuẩn bước 1 là hóa chất bộ đôi có platinum kết hợp hoặc không xạ trị dự phòng não. Hóa chất gồm cisplatin/carboplatin kết hợp etoposid hoặc irinotecan. Carboplatin dễ dung nạp hơn cisplatin và hóa chất điều trị từ 4-6 chu kỳ.
Mặc dù nhạy cảm với hóa chất nhưng đa số bệnh nhân tái phát trong vòng 1 năm điều trị. Nếu tái phát trong quá trình điều trị gọi là không nhạy cảm platinum, nếu tái phát trong vòng 90 ngày từ khi dừng điều trị gọi là kháng platinum, nếu tái phát sau 90 ngày gọi là nhạy cảm platinum. Với trường hợp tái phát nhạy platinum thì nên dùng lại phác đồ có platinum hơn là dùng topotecan.
Liệu pháp miễn dịch
Thuốc ức chế PD-L1 atezolizumab và durvalumab kết hợp hóa chất đã cải thiện đáng kể hiệu quả điều trị. Khuyến cáo dùng thuốc miễn dịch dựa trên các thử nghiệm, Impower133 và CASPIAN so sánh hai thuốc miễn dịch trên với hóa trị.
IMpower133 kết hợp atezolizumab và carboplatin/etoposid cải thiện thời gian sống sót (OS) với OS trung bình 12.3 tháng so với 10.3 tháng hóa chất đơn thuần. Tuy vậy chỉ có 12.6% bệnh nhân không tiến triển bệnh ở thời điểm 1 năm với thời gian sống không tiến triển trung bình (PFS) là 5.2 tháng với atezolizumab và 4.2 tháng hóa chất.
Trong thử nghiệm CASPIAN, durvalumab kết hợp cisplatin hoặc carboplatin/etoposid cũng cải thiện OS với OS trung bình đạt 13 tháng so với 10.3 tháng hóa chất đơn thuần. Ở thời điểm 18 tháng có 34% bệnh nhân nhóm miễn dịch còn sống so với chỉ 25% nhóm hóa chất. Mặc dù vậy giá trị PFS của nhóm durvalumab chỉ 5.1 tháng so với 5.4 tháng hóa chất. Chú ý, kết hợp tremelimumab là một kháng thể đơn dòng chống CTLA-4 vào phác đồ durvalumab+platinum/etoposid không cải thiện OS so với hóa chất platinum đơn thuần.
Khi điều trị duy trì sau 4 chu kỳ tấn công, atezolizumab dùng mỗi 3 tuần, durvalumab dùng mỗi 4 tuần tới khi bệnh tiến triển.
Trilaciclib
Năm 2021, thuốc ức chế CDK4/6 trilaciclib được chấp thuận là thuốc bảo vệ tủy xương không độc tế bào. Thử nghiệm pha 2 ở giai đoạn lan tràn G1T28-02, G1T28-05, G1T28-03 thu nhận 245 bệnh nhân dùng trilaciclib hoặc giả dược trước điều trị trong ngày 1 đến 3 của chu kỳ 21 ngày. Kết quả trilaciclib giảm thời gian và tỉ lệ hạ bạch cầu nặng ở chu kỳ hóa chất đầu tiên mặc dù OS và PFS không cải thiện.
Tiêu chí đầu tiên bảo vệ tủy gồm thời gian và tỉ lệ hạ bạch cầu nặng độ 4 (DSN) ở chu kỳ 1. Tiêu chí thứ 2 bảo vệ tủy là thiếu máu và giảm tiểu cầu. Trilaciclib giảm đáng kể các độc tính tủy xương và nhu cầu can thiệp, thời gian hạ bạch cầu nặng trung bình là 0 so với 4 ngày ở nhóm chứng. Sau chu kỳ hóa chất 1, chỉ 8.9% nhóm điều trị trilaciclib cần giảm liều hóa chất so với 30.3% ở nhóm chứng. Ngoài ra chỉ 6.5% bệnh nhân nhóm trilaciclib gặp độc tính nặng hoặc 19.5% cần kháng sinh tĩnh mạch so với 10.1% và 23.5% tương ứng ở nhóm chứng.
Tiragolumab
Tiragolumab là thuốc ức chế điểm miễn dịch kháng TIGIT là con đường bổ trợ nhưng khác biệt với con đường kháng PD-1/PD-L1. Thuốc này đã thất bại ở giá trị PFS và OS trong thử nghiệm pha 3 SKYCRAPER-02 so sánh atezolizumab/carboplatin/etoposid kết hợp hoặc không với tiragolumab. Trước đó tiragolumab được chấp nhận thiết kế điều trị bước 1 kết hợp atezolizumab trong ung thư phổi không tế bào nhỏ có mức độ bộc lộ cao PD-L1 và không có đột biến gen EGFR, ALK.
Liệu pháp miễn dịch duy trì sau hóa chất platinum bước 1
Sự tái phát sau điều trị bước 1 hóa chất dẫn tới cần điều trị duy trì. Tuy nhiên hiệu quả của thuốc miễn dịch còn hạn chế. Trong thử nghiệm CheckMate-451, bệnh nhân đáp ứng sau hóa trị bước 1 được phân 1:1:1 dùng nivolumab, nivolumab+ipilimumab, placebo duy trì. Kết hợp nivolumab+ipilimumab không cải thiện được OS so với placebo (9.2 và 9.6 tháng), mặc dù PFS có tốt hơn chút ít (1.7 và 1.4 tháng)
Chỉ khi bổ sung thuốc ức chế PD-L1 atezolizumab và durvalumab vào phác đồ platinum sau đó tiếp tục duy trì mới cải thiện PFS và OS. Ngược lại, thuốc ức chế PD-1 pembrolizumab kết hợp hóa chất và duy trì chỉ cải thiện được PFS mà không cải thiện OS. Các khối u của thể ung thư tế bào nhỏ thường ít bộc lộ PD-L1 so với ung thư phổi không tế bào nhỏ.
4. Điều trị bước 2
Sau khi tái phát bệnh nhân phân thành nhóm nhạy cảm và kháng trị tùy theo khoảng thời gian đáp ứng với hóa chất bước 1. Nếu tái phát >90 ngày từ lần hóa trị bước 1 cuối cùng gọi là nhạy cảm, và bệnh thường có đáp ứng hoàn toàn hoặc một phần. Trong khi thất bại với hóa trị bước 1 hoặc tái phát <90 ngày từ đợt hóa trị cuối gọi là kháng trị. Điều trị bước 2 gồm: dùng lại hóa chất platinum bước 1 nếu nhóm nhạy cảm hoặc dùng topotecan hoặc lurbinectidin.
Topotecan
Topotecan là thuốc ức chế topoisomerase được chấp thuận năm 1998 dựa trên thử nghiệm pha 3 gồm 211 bệnh nhân tái phát sau ít nhất 60 ngày từ điều trị ban đầu. Bệnh nhân dùng topotecan so với phác đồ CAV. Trong khi OS, thời gian đến khi tiến triển, tỉ lệ đáp ứng là tương đương giữa 2 nhóm; độc tính lại khác biệt: khó thở, mệt mỏi, chán ăn đều cải thiện hơn với topotecan.
Eckardt và cộng sự tiến hành thử nghiệm pha 3 so sánh topotecan dạng uống và tĩnh mạch ở nhóm tái phát trên 309 bệnh nhân. Tỉ lệ đáp ứng tương đương (18.3% và 21.9%), không khác biệt về thời gian đến khi đáp ứng (6.1 tuần cả 2 nhóm), thời gian đáp ứng (18.3 tuần và 25.4 tuần), thời gian đến khi tiến triển (11.9 tuần và 14.6 tuần).
Topotecan có các độc tính giới hạn liều như độc tính huyết học gồm: hạ bạch cầu, thiếu máu, giảm tiểu cầu và các độc tính ngoài huyết học như: mệt mỏi, rụng tóc, buồn nôn, tiêu chảy gặp <20%. Như vậy topotecan chỉ áp dụng với nhóm nhạy platinum.
Dùng lại phác đồ carboplatin/etoposid
Trong thử nghiệm pha 3 French năm 2020 với bệnh nhân tái phát sau phác đồ platinum bước 1 ≥ 90 ngày sau khi hoàn thành điều trị. Bệnh nhân được dùng lại phác đồ platinum so với topotecan. Kết quả PFS dài hơn đáng kể ở nhóm platinum so với topotecan (4.7 và 2.7 tháng). Điều này gợi ý carboplatin/etoposid là ưu tiên ở nhóm tái phát nhạy platinum.
Trong thử nghiệm ở Nhật Bản, OS dài hơn đáng kể ở nhóm hóa chất platinum+topotecan so với topotecan đơn thuần (18.2 và 12.5 tháng).
Lurbinectedin
Lurbinectedin là thuốc ức chế yếu tố sao chép RNA polymerase II thể hiện hoạt tính kháng ung thư dưới dạng đơn chất hoặc kết hợp doxorubicin.
Thử nghiệm pha 2 gồm bệnh nhân nhạy cảm và kháng platinum dùng 3.2mg/m2 lurbinectedin tĩnh mạch mỗi 3 tuần. Tỉ lệ đáp ứng đạt 35.2% với thời gian đáp ứng trung bình 5.3 tháng và PFS trung bình 3.5 tháng, OS trung bình 9.3 tháng. Lurbinectedin được FDA chấp thuận điều trị bước 2 sau tiến triển hóa chất platinum. Độc tính huyết học gồm độ 4 hạ bạch cầu 25%, độ 4 hạ tiểu cầu 4% và 10% gặp độc tính nặng. Độc tính ngoài huyết học gồm mệt mỏi, giảm ngon miệng và triệu chứng tiêu hóa.
5. Điều trị bước 3
Hiện nay chưa có phác đồ điều trị bước 3.
6. Các thuốc đang được phát triển
RRx-001 + EP (pha 3)
Thuốc đối kháng CD-47, C-MYC và VEGF cũng như hoạt hóa gen p53 im lặng có khả năng kết hợp cả hoạt tính độc tế bào u và bảo vệ mô lành gồm bảo vệ độc tính tủy xương do platinum. RRx-001 đang được thử nghiệm pha 3 REPLATINUM kết hợp độc tế bào/bảo vệ tủy trong điều trị bước 3 và các bước sau ung thư phổi tế bào nhỏ.
Velaparib
Velaparib là thuốc ức chế PARP vốn chống lại sửa chữa DNA. Enzyme PARP bộc lộ nhiều trong ung thư phổi tế bào nhỏ. Trong thử nghiệm pha 2 velaparib kết hợp EP ở bệnh nhân chưa điều trị đã thể hiện cải thiện PFS từ 5.6 đến 5.8 tháng nhưng không có lợi ích OS.
Việc phát hiện chất Schlafen (SLFN11) tạo xoắn DNA/RNA có thể dự báo nhạy cảm với thuốc ức chế PARP. SLFN11 vốn bộc lộ cao trong ung thư phổi tế bào nhỏ sẽ giảm bộc lộ đáng kể sau điều trị velaparib.
Temozolomide
Temozolomide (TMZ) là chất alkyl hóa có hoạt tính trong ung thư phổi tế bào nhỏ, có thể đồng vận với thuốc ức chế PARP chống lại sự sửa chữa hư hại DNA do TMZ gây ra.
Pietanza và cộng sự tiến hành so sánh TMZ kết hợp velaparib hoặc giả dược về hiệu quả. PFS trung bình và OS không khác nhau giữa hai nhóm, tuy nhiên PFS và OS lại cải thiện đáng kể ở nhóm có SLFN11 dương tính khi điều trị bằng TMZ+velaparib (5.7 và 3.6 tháng), (12.2 và 7.5 tháng). Các nghiên cứu khác đang tiến hành kết hợp thuốc ức chế PARP và chất gây tổn thương DNA như pegylated SN-38, chất chuyển hóa irinotecan và thuốc ức chế hoạt tính topoimerase I.
Thuốc kháng sinh mạch
Do tầm quan trọng của sự tăng sinh mạch máu trong ung thư phổi tế bào nhỏ và mối liên quan giữa sự giảm sống sót và nồng độc cao VEGF huyết thanh, nên việc kết hợp thuốc miễn dịch và thuốc kháng sinh mạch đang được đánh giá với hi vọng sự bình thường hóa mạch máu sẽ giúp thâm nhiễm tốt hơn tế bào lympho T vào khối u và giảm sự thiếu oxy sẽ đồng vận với thuốc miễn dịch. Ví dụ thuốc AK112 là kháng thể đặc hiệu chống PD-1 và VEGF đang được thử nghiệm pha 1b/2 với hóa chất carboplatin/etoposide.
Các kết hợp hóa miễn dịch khác
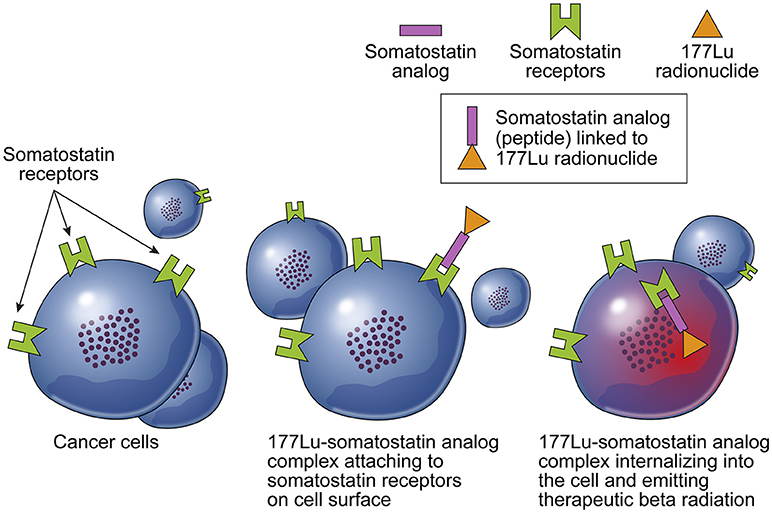
Các kết hợp hóa chất miễn dịch mới như 177Lu-DOTATATE là liệu pháp đích receptor somatostatin gắn đồng vị phóng xạ do ung thư phổi tế bào nhỏ là u thần kinh nội tiết bộc lộ receptor somatostatin.
BMS-986012 là kháng thể đơn dòng kháng fucosyl-GM1 được thử nghiệm pha 2 do fucosyl-GM1 là kháng nguyên kết hợp khối u bộc lộ cao trên tế bào ung thư phổi tế bào nhỏ mà không có ở trên mô thường. LB-100 là thuốc ức chế phân tử nhỏ protein phosphatase 2A (PP2A) quá bộc lộ trên tế bào ác tính.
TÀI LIỆU THAM KHẢO
Oronsky B, Abrouk N, Caroen S, Lybeck M, Guo X, Wang X, Yu Z, Reid T. A 2022 Update on Extensive Stage Small-Cell Lung Cancer (SCLC). J Cancer. 2022 Jul 18;13(9):2945-2953. doi: 10.7150/jca.75622. PMID: 35912017; PMCID: PMC9330463.
Để biết thêm chi tiết xin liên hệ:
- Ths.Bs. Trần Khôi.
- Bệnh viện Phổi Hà Nội
- 44 Thanh Nhàn, Hai Bà Trưng, Hà Nội
- Hotline: 0983 812 084, 0913 058 294
- CHỮA BỆNH UNG THƯ PHỔI: https://www.facebook.com/groups/894940984347355
- YouTube: https://www.youtube.com/channel/UCjueL8VycYzFjGkVcglHV2g




