THUỐC MIỄN DỊCH ĐIỀU TRỊ UNG THƯ PHỔI: CƠ CHẾ TÁC DỤNG
15:13 - 26/04/2025
Thuốc miễn dịch (ICI) trong ung thư phổi: Cơ chế tác động và ứng dụng
Khối u giảm càng nhiều, sống càng lâu: Giá trị tiên lượng trong điều trị ung thư phổi đột biến EGFR
Giảm khối u càng sâu, sống càng lâu: Đột phá trong điều trị ung thư phổi EGFR bằng thuốc nhắm trúng đích
Thuốc đích EGFR trong điều trị ung thư phổi giai đoạn 4: Thời gian lui bệnh và ý nghĩa lâm sàng
Hiệu quả thuốc đích Osimertinib trong điều trị di căn gan ung thư phổi đột biến EGFR+ giai đoạn 4
Ức chế điểm kiểm soát miễn dịch (ICI) trong ung thư phổi: Cơ chế tác động và ứng dụng lâm sàng
I. Giới thiệu chung
Ung thư phổi, đặc biệt là ung thư phổi không tế bào nhỏ (NSCLC), vẫn là nguyên nhân gây tử vong hàng đầu do ung thư trên toàn thế giới. Mặc dù các phương pháp điều trị truyền thống như hóa trị, xạ trị và phẫu thuật đã cải thiện tiên lượng bệnh, tỷ lệ sống còn dài hạn vẫn còn khiêm tốn.
Trong thập kỷ qua, sự hiểu biết sâu sắc về sinh học ung thư và miễn dịch học đã dẫn đến sự ra đời của liệu pháp miễn dịch – đặc biệt là các thuốc ức chế điểm kiểm soát miễn dịch (Immune Checkpoint Inhibitors – ICI), mở ra một kỷ nguyên mới trong điều trị ung thư phổi.
II. Các checkpoint miễn dịch trong ung thư
Checkpoint miễn dịch là các phân tử điều hòa âm tính, có vai trò thiết yếu trong việc duy trì cân bằng miễn dịch, ngăn ngừa hoạt hóa miễn dịch không kiểm soát và tự miễn. Tuy nhiên, các tế bào ung thư có thể khai thác các checkpoint này để thoát khỏi sự tấn công của hệ miễn dịch.
Hai checkpoint quan trọng nhất trong ung thư phổi là:
CTLA-4 (Cytotoxic T-lymphocyte-associated protein 4)
PD-1 (Programmed cell death protein 1) và PD-L1 (Programmed death-ligand 1)
III. Cơ chế tác động sinh lý của các checkpoint
1. CTLA-4
Biểu hiện: CTLA-4 được biểu hiện trên T-cell sau khi T-cell được kích hoạt thông qua TCR.
Vai trò: CTLA-4 cạnh tranh với CD28 để gắn vào B7-1 (CD80) và B7-2 (CD86) trên APCs, với ái lực cao hơn CD28, do đó ức chế hoạt hóa T-cell ngay từ giai đoạn priming trong hạch lympho.
Kết quả: CTLA-4 giúp duy trì dung nạp miễn dịch bằng cách làm giảm sự tăng sinh và hoạt hóa của T-cell hiệu quả (effector T cells).
2. PD-1 và PD-L1
PD-1: Thụ thể ức chế được biểu hiện trên T-cell, B-cell và tế bào NK sau khi chúng được hoạt hóa.
PD-L1: Được biểu hiện chủ yếu bởi tế bào ung thư và một số tế bào miễn dịch khác trong môi trường vi mô khối u (TME).
Vai trò: Khi PD-L1 gắn với PD-1 trên T-cell, sẽ ức chế tín hiệu kích hoạt, giảm tiết cytokine, giảm khả năng tăng sinh và gây kiệt sức miễn dịch (T-cell exhaustion).
IV. Các loại thuốc ICI được sử dụng trong ung thư phổi
| Nhóm thuốc | Tên thuốc nổi bật | Cơ chế |
|---|---|---|
| Anti-CTLA-4 | Ipilimumab | Phong tỏa CTLA-4, tăng hoạt hóa T-cell ban đầu |
| Anti-PD-1 | Nivolumab, Pembrolizumab | Phong tỏa PD-1, phục hồi chức năng T-cell trong TME |
| Anti-PD-L1 | Atezolizumab, Durvalumab | Phong tỏa PD-L1, tương tự anti-PD-1 |
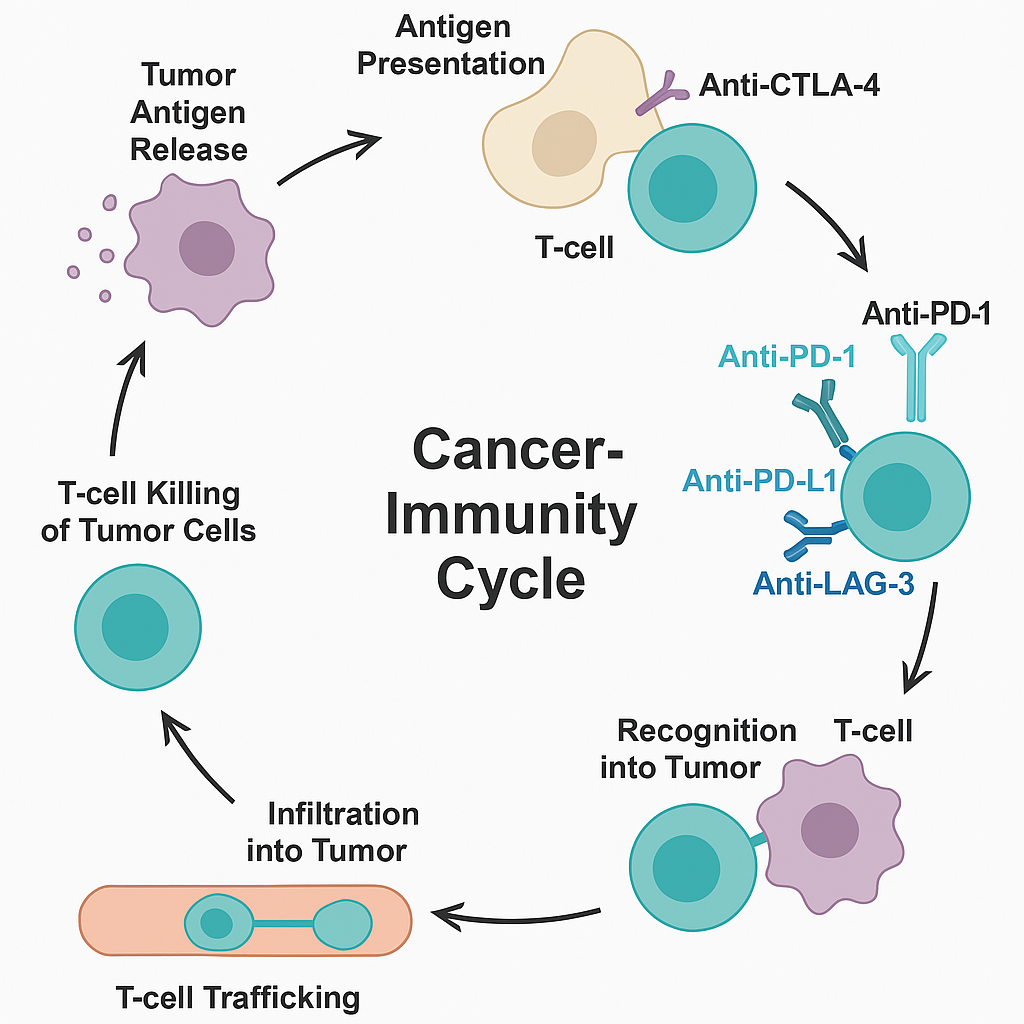
V. Cơ chế tác động của ICI trong ung thư phổi
1. Chặn tương tác PD-1/PD-L1
Anti-PD-1 hoặc Anti-PD-L1 ngăn PD-1 trên T-cell gắn vào PD-L1 trên tế bào u hoặc APCs.
Phục hồi hoạt động T-cell đã bị ức chế: khôi phục tăng sinh, tiết IFN-γ, TNF-α và khả năng tiêu diệt tế bào ung thư.
2. Tăng hoạt hóa T-cell đặc hiệu kháng nguyên
Phong tỏa CTLA-4 giúp gia tăng tín hiệu đồng kích thích CD28 trong hạch lympho.
Mở rộng số lượng T-cell đặc hiệu với kháng nguyên khối u, từ đó tăng cường tấn công hệ thống vào khối u.
3. Điều chỉnh môi trường vi mô khối u (TME)
Giảm số lượng T-reg: Anti-CTLA-4 có thể tiêu diệt T-reg trong khối u thông qua ADCC.
Tăng sự xâm nhập của tế bào miễn dịch: sau khi dùng ICI, khối u có thể chuyển từ "cold tumor" thành "hot tumor", với lượng lớn T-cell xâm nhập.
VI. Các yếu tố quyết định đáp ứng với ICI trong ung thư phổi
1. Mức độ bộc lộ PD-L1
Được xác định bằng miễn dịch hóa mô (IHC).
Bệnh nhân NSCLC có PD-L1 ≥50% thường đáp ứng tốt với ICI đơn trị.
2. TMB (Tumor Mutational Burden)
Khối u có TMB cao tạo nhiều neoantigen → dễ dàng bị nhận diện và tiêu diệt bởi hệ miễn dịch khi ICI được sử dụng.
3. Sự hiện diện của tế bào miễn dịch trong TME
"Hot tumors" (có nhiều tế bào miễn dịch xâm nhập) đáp ứng ICI tốt hơn "cold tumors".
VII. Cơ chế đề kháng với ICI
1. Đề kháng nguyên phát (Primary resistance)
Khối u không biểu hiện kháng nguyên.
Thiếu tế bào miễn dịch thâm nhập.
2. Đề kháng mắc phải (Acquired resistance)
Mất biểu hiện MHC-I.
Đột biến JAK/STAT gây giảm đáp ứng interferon.
Tăng biểu hiện các checkpoint khác như LAG-3, TIM-3.
VIII. Tác dụng phụ của ICI (irAEs)
| Cơ quan | Tác dụng phụ phổ biến |
|---|---|
| Da | Phát ban, ngứa |
| Tiêu hóa | Viêm đại tràng, tiêu chảy |
| Gan | Viêm gan, tăng men gan |
| Tuyến nội tiết | Viêm giáp, viêm tuyến yên |
| Phổi | Viêm phổi kẽ |
Cơ chế: Mất cân bằng dung nạp miễn dịch → hệ miễn dịch tấn công mô lành.
Quản lý: Corticosteroids, liệu pháp ức chế miễn dịch khác (ví dụ: infliximab).
IX. Ứng dụng lâm sàng hiện tại của ICI trong NSCLC
1. ICI đơn trị
Pembrolizumab được chỉ định đơn trị cho NSCLC giai đoạn tiến xa, PD-L1 ≥50%, không đột biến EGFR/ALK.
2. ICI kết hợp hóa trị
Phối hợp pembrolizumab + platinum-based chemotherapy → cải thiện OS so với hóa trị đơn thuần.
3. ICI kết hợp ICI
Nivolumab + ipilimumab được dùng cho NSCLC TMB cao, PD-L1 ≥1%, đặc biệt ở bệnh nhân không thích hợp hóa trị.
X. Kết luận
Liệu pháp miễn dịch bằng cách ức chế checkpoint (ICI) đã tạo ra bước ngoặt lớn trong điều trị ung thư phổi. Việc hiểu rõ cơ chế tác động, yếu tố tiên lượng, cơ chế kháng và cách quản lý tác dụng phụ là chìa khóa để tối ưu hóa hiệu quả và đảm bảo an toàn cho bệnh nhân.
Tuy nhiên, việc ứng dụng ICI cần được cá nhân hóa dựa trên đặc điểm sinh học của khối u, tình trạng miễn dịch tổng thể của bệnh nhân, và cân nhắc kỹ lưỡng nguy cơ – lợi ích.
Trong tương lai, việc kết hợp ICI với các liệu pháp mới như vaccine ung thư, liệu pháp CAR-T, hoặc liệu pháp sinh học khác có thể tiếp tục mở rộng tiềm năng chiến thắng ung thư phổi.
Cần tư vấn chuyên sâu về các thuốc điều trị ung thư phổi:
- ThS – BS Trần Khôi
- Bệnh viện Phổi Hà Nội – 44 Thanh Nhàn, Hai Bà Trưng
- Zalo: 0983 812 084 – Hotline: 0913 058 294
- Facebook: Bác sĩ Trần Khôi
- Kênh YouTube: Thạc sĩ Bác sĩ Trần Khôi – Chữa bệnh ung thư phổi




