Giảm khối u càng sâu, sống càng lâu: Đột phá trong điều trị ung thư phổi EGFR bằng thuốc nhắm trúng đích
10:05 - 06/06/2025
Phân tích chuyên sâu hai nghiên cứu lớn tại Nhật Bản và Trung Quốc cho thấy bệnh nhân ung thư phổi có đột biến EGFR sẽ sống lâu hơn rõ rệt nếu khối u giảm sâu khi dùng thuốc đích như gefitinib, erlotinib. Bài viết giúp bác sĩ và bệnh nhân hiểu đúng vai trò của chiều sâu đáp ứng (DepOR) trong điều trị.
So sánh thời gian sống không tiến triển trong ung thư phổi giai đoạn 4: phác đồ nào giữ bệnh đứng yên lâu nhất?
Chọn đúng thuốc – Cơ hội sống dài hơn cho bệnh nhân ung thư phổi giai đoạn 4
Chọn đúng thuốc ung thư phổi giai đoạn 4 để sống lâu hơn
Các loại vắc xin điều trị ung thư: cơ chế, hiệu quả, hướng điều trị tiếp theo
ĐÁNH GIÁ SINH HỌC VÀ LÂM SÀNG CÁC CHỈ DẤU ĐÁP ỨNG TRONG ĐIỀU TRỊ NSCLC CÓ ĐỘT BIẾN EGFR BẰNG EGFR-TKI
1. GIỚI THIỆU
Ung thư phổi không tế bào nhỏ (NSCLC) chiếm khoảng 85% tổng số ca ung thư phổi và là nguyên nhân hàng đầu gây tử vong do ung thư trên toàn cầu. Trong vòng 20 năm qua, các đột phá về mặt di truyền học đã xác định rằng khoảng 15–50% bệnh nhân NSCLC, đặc biệt là người châu Á không hút thuốc, có mang đột biến hoạt hóa gen EGFR. Những đột biến này khiến khối u nhạy cảm đặc hiệu với nhóm thuốc ức chế tyrosine kinase của thụ thể yếu tố tăng trưởng biểu bì (EGFR-TKI), bao gồm gefitinib, erlotinib và icotinib.
Trong thực hành lâm sàng, đánh giá hiệu quả điều trị chủ yếu dựa trên tiêu chuẩn RECIST, phân loại bệnh nhân thành các nhóm CR (đáp ứng hoàn toàn), PR (đáp ứng một phần), SD (bệnh ổn định) và PD (bệnh tiến triển). Tuy nhiên, tiêu chuẩn này có thể không phản ánh đầy đủ sự biến thiên trong đáp ứng sinh học – đặc biệt trong điều trị đích. Hai nghiên cứu của Takeda (2014) và Liu (2019) đã cung cấp các bằng chứng giá trị cho thấy mức độ đáp ứng và chiều sâu đáp ứng (Depth of Response – DepOR) có thể là chỉ dấu tiên lượng quan trọng hơn.
2. TỔNG QUAN NGHIÊN CỨU
2.1. Nghiên cứu của Takeda et al. (2014)
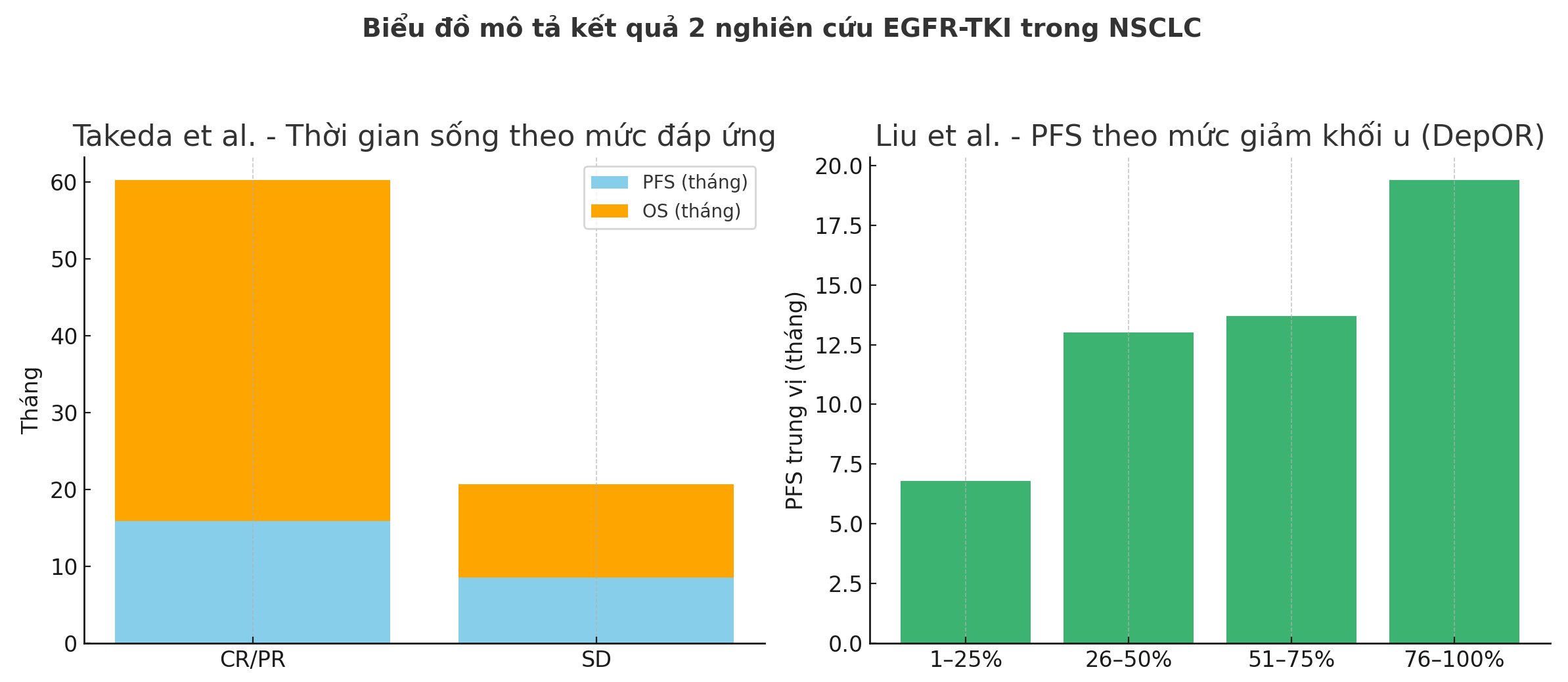
- Mục tiêu: Phân tích mối liên hệ giữa mức độ đáp ứng (CR, PR, SD) và thời gian sống (PFS, OS) ở bệnh nhân NSCLC có đột biến EGFR điều trị với EGFR-TKI.
- Đối tượng: 68 bệnh nhân tại Nhật Bản với NSCLC đột biến EGFR (exon 19 deletion hoặc L858R), có dữ liệu hình ảnh đầy đủ theo RECIST.
- Phát hiện chính:
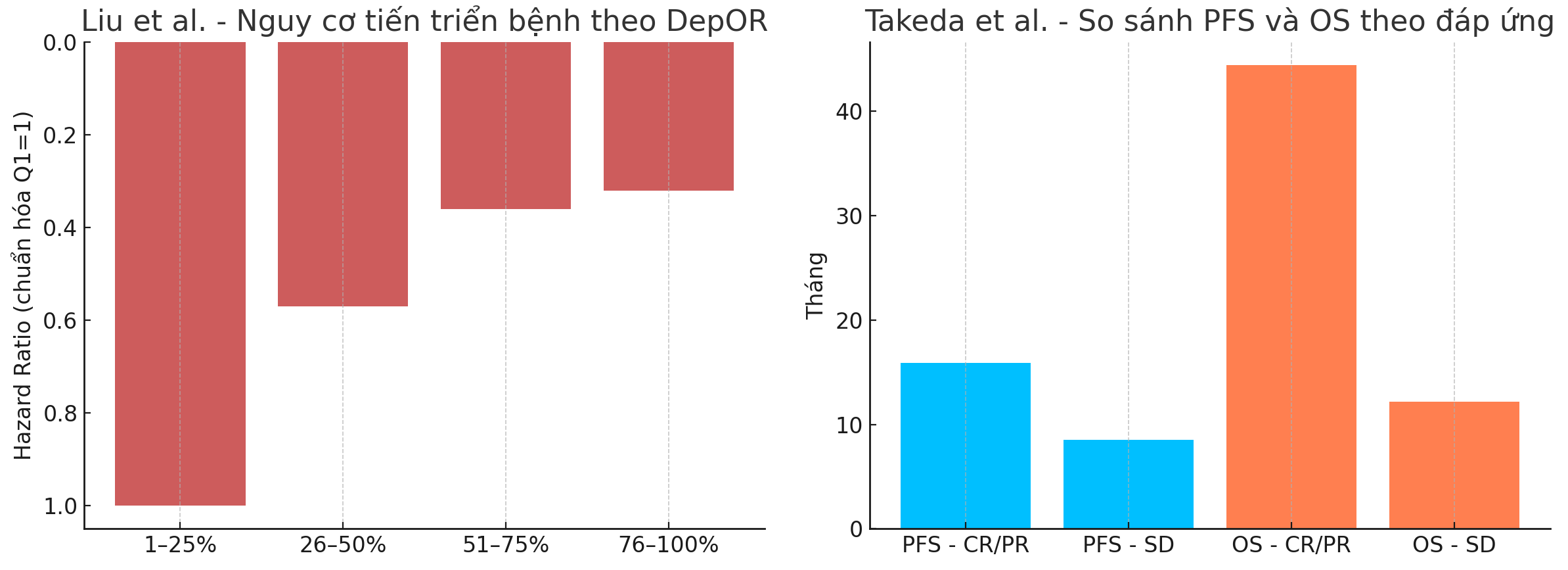
- Nhóm CR/PR có PFS trung vị 15.9 tháng, so với 8.5 tháng ở nhóm SD (p=0.009).
- Nhóm CR/PR có OS trung vị 44.4 tháng, so với 12.2 tháng ở nhóm SD (p=0.004).
- Mức độ co khối u nhiều hơn không liên quan đến PFS hoặc OS.
- TTR (Time to Response) ngắn hơn không tiên đoán được sống còn tốt hơn.
2.2. Nghiên cứu của Liu et al. (2019)
- Mục tiêu: Xác định mối liên hệ giữa chiều sâu đáp ứng (DepOR – phần trăm thu nhỏ lớn nhất so với ban đầu) và PFS ở bệnh nhân NSCLC có đột biến EGFR.
- Đối tượng: 265 bệnh nhân từ hai bệnh viện lớn ở Trung Quốc, điều trị bằng gefitinib, erlotinib hoặc icotinib.
- Phân nhóm DepOR:
- Q1: 1–25%
- Q2: 26–50%
- Q3: 51–75%
- Q4: 76–100%
- Kết quả:
- PFS trung vị theo nhóm: Q1 (6.8 tháng), Q2 (13.0), Q3 (13.7), Q4 (19.4 tháng) (p < 0.0001).
- DepOR là yếu tố tiên lượng độc lập ngay cả sau khi hiệu chỉnh theo giới, LDH và di căn não.
3. PHÂN TÍCH VÀ DIỄN GIẢI
3.1. Vai trò của mức độ đáp ứng hình ảnh (Takeda et al.)
Nghiên cứu của Takeda và đồng sự (2014) đã đặt ra một vấn đề then chốt: Liệu những bệnh nhân NSCLC có đột biến EGFR khi điều trị với EGFR-TKI mà đạt được PR hoặc CR (giảm khối u đáng kể) sẽ có tiên lượng sống tốt hơn những người chỉ đạt mức “bệnh ổn định” (SD)?
Kết quả cho thấy rõ ràng: Bệnh nhân đạt CR/PR có thời gian sống không tiến triển (PFS) trung bình lên đến 15.9 tháng, và OS trung bình lên đến 44.4 tháng – cao gấp ôn hơn nhiều so với nhóm SD (8.5 tháng và 12.2 tháng).
Sự khác biệt này không chỉ mang ý nghĩa thống kê mà còn mang ý nghĩa lâm sàng to lớn:
- SD được coi như “một đáp ứng có thể chấp nhận” theo RECIST, nhưng thực chất chỉ phản ánh mức độ hiệu quả trung gian.
- Khối u có thể không phát triển thêm, nhưng cũng không giảm đủ nhiều để mang lại lợi ích sống lâu dài.
- Từ góc nhìn sâu hơn, SD đều có nguy cơ mang các cơ chế kháng thuốc tiềm tàng, như T790M hoặc MET overexpression.
Từ phát hiện này, chúng ta học được rằng:
- Bác sĩ cần theo dõi chặt chẽ nhóm SD để phát hiện sớm diễn tiến.
- Các nghiên cứu trong tương lai nên chia nhỏ nhóm SD dựa trên tỷ lệ co khối u nhỏ hơn.
3.2. Vai trò của chiều sâu đáp ứng (Depth of Response - DepOR)
Trong khi Takeda chia bệnh nhân theo mức độ đáp ứng theo RECIST (CR, PR, SD, PD) thì Liu et al. (2019) đã bước tiếp theo để biến đáp ứng trở thành chỉ số định lượng: DepOR. Định nghĩa: DepOR là tỷ lệ phần trăm khối u co nhiều nhất so với trước điều trị.
Liu chia bệnh nhân thành 4 nhóm theo DepOR:
- Q1: 1–25%
- Q2: 26–50%
- Q3: 51–75%
- Q4: 76–100%
Kết quả:
- Nhóm Q4 sống lâu gần gấp 3 lần nhóm Q1 (19.4 tháng vs 6.8 tháng)
- P < 0.0001, HR giữa Q4 và Q1 là 0.32 sau hiệu chỉnh nhiều yếu tố
Vì sao DepOR được coi là đồng biến đáng tin cậy?
- Cho phép đánh giá hiệu quả sớm đáng tin cậy
- Đo lường mức độ tác động sinh học của thuốc
- Hỗ trợ quyết định việc duy trì hay chuyển điều trị
Trong phân tích đa biến, DepOR vẫn giữ vai trò độc lập bất kể giới tính, di căn não hay men LDH.
3.3. So sánh hai tiếp cận – RECIST vs DepOR
Tiêu chí | RECIST (Takeda) | DepOR (Liu) |
Phân loại | CR, PR, SD, PD | 4 nhóm theo % |
Tính định lượng | Không | Có |
Phản ánh chi tiết | Giới hạn | Rõ ràng |
Tiên lượng | Tốt cho CR/PR | Tuyệt vời theo mức giảm |
DepOR được coi như công cụ tiến bộ mới, khắc phụ hạn chế đo đơn chiều của RECIST.
3.4. Yếu tố ảnh hưởng khác: LDH, giới tính, di căn não
- LDH cao: dấu hiệu kháng viêm, tải lượng u cao, tiên lượng xấu
- Di căn não: hạn chế hiệu quả do EGFR-TKI thế hệ 1-2 không vượt qua được blood-brain barrier
- Nam giới: kém đáp ứng hơn, có thể do khác biệt hormone hoặc tần suất đột biến
DepOR giúc trung hoà tác động tiên lượng của các yếu tố này: ngay cả khi có LDH cao hay di căn não, nếu u giảm mạnh, bệnh nhân vẫn có tiên lượng tốt.
3.5. Kế luận chiến lược tại Việt Nam
Trong bối cảnh nước ta:
- Việc đánh giá u co bao nhiêu % chưa được thực hiện chuẩn hóa
- Nhiều bệnh nhân chỉ nghe bác sĩ nói "đang ổn"
- Cần đưa DepOR hoặc chỉ số đáp ứng vào hồ sơ điều trị
=> Tăng minh bạch, gắn trách nhiệm, và giúc gia đình theo dõi chặt chẽ hơn.
4. Ý NGHĨA LÂM SÀNG VÀ THỰC HÀNH
4.1. Ứng dụng trong theo dõi điều trị
- Cần đánh giá mức độ co khối u (DepOR) trong mỗi lần chụp CT sau 6-8 tuần điều trị.
- Cân nhắc duy trì điều trị nếu u giảm đáng kể (DepOR ≥50%).
- Cân nhắc chuyển điều trị, sinh thiết lại hoặc lên kế hoạch nghiên cứu kháng thuốc nếu DepOR <25% hoặc SD.
4.2. Hướng dẫn quyết định liệu pháp kế tiếp
- Cần hiểu DepOR là một chỉ số để đo đạt mức độ hiệu quả của thuốc
- Hỏi bác sĩ: "Khối u đã giảm bao nhiêu %?" thay vì chỉ nghe "bệnh đang ổn"
- Quyết định tiếp tục hay chuyển hướng dựa trên thông tin khoa học cụ thể.
4.3. Tối ưu thiết kế thử nghiệm lâm sàng
- Cần chuẩn hóa quy trình đánh giá DepOR trong bảng theo dõi hồ sơ bệnh án
- Cung cấp chỉ số này cho người bệnh và gia đình sau mỗi đợt chụp phim
- Áp dụng DepOR như là chỉ số KPI đánh giá chất lượng hiệu quả điều trị.
4.4. Đối với thiết kế nghiên cứu
- Các thử nghiệm lâm sàng cần đưa DepOR làm endpoint bổ sung hoặc chính
- So sánh DepOR giữa các nhóm thuốc sẽ phản ánh nhạy hơn so với ORR
- Kết hợp với các marker sinh học mô phôi (ctDNA, TMB) để xây dựng hệ dự đoán hành vi không đáp ứng sớm.
5. GIỚI HẠN VÀ HƯỚNG NGHIÊN CỨU TƯƠNG LAI
Hạn chế | Cả hai nghiên cứu |
Thiết kế | Hồi cứu |
Biến thiên về điều trị | Có sử dụng nhiều loại EGFR-TKI |
Chưa phân tích OS | Chỉ đánh giá PFS |
Chưa xác minh trong TKI thế hệ mới | Osimertinib chưa được bao gồm |
Hướng đi tiếp theo:
- Nghiên cứu tiền cứu đa trung tâm
- Áp dụng cho Osimertinib và TKI thế hệ thứ ba
- So sánh giữa DepOR, early tumor shrinkage (ETS), và RECIST
6. KẾT LUẬN
- Đáp ứng hình ảnh mạnh (CR/PR) và chiều sâu đáp ứng (DepOR) cao đều là chỉ dấu tiên lượng mạnh cho PFS ở bệnh nhân NSCLC có đột biến EGFR được điều trị bằng EGFR-TKI.
- DepOR nên được xem là công cụ đánh giá bổ sung quan trọng trong thực hành lâm sàng và thiết kế nghiên cứu.
- Cần tích hợp DepOR vào hệ thống đánh giá chuẩn (RECIST+) để định hướng chiến lược điều trị cá nhân hóa.
TÀI LIỆU THAM KHẢO
- Takeda M, et al. J Thorac Oncol. 2014;9(2):200–204.
- Liu YT, et al. J Cancer. 2019;10(21):5108–5113.
Cần tư vấn chuyên sâu về các thuốc điều trị ung thư phổi:
- ThS – BS Trần Khôi
- Bệnh viện Phổi Hà Nội – 44 Thanh Nhàn, Hai Bà Trưng
- Zalo: 0983 812 084 – Hotline: 0913 058 294
- Facebook: Bác sĩ Trần Khôi
- Kênh YouTube: Thạc sĩ Bác sĩ Trần Khôi – Chữa bệnh ung thư phổi




