THUỐC ĐÍCH ĐIỀU TRỊ UNG THƯ PHỔI VÀ NHỮNG BƯỚC TIẾN MỚI
21:13 - 28/12/2022
Các cơ chế kháng thuốc với các loại thuốc đích điều trị ung thư phổi hiện nay và các thuốc mới đang được nghiên cứu để vượt qua các đột biến kháng thuốc do tế bào ung thư phổi gây ra.
Khối u giảm càng nhiều, sống càng lâu: Giá trị tiên lượng trong điều trị ung thư phổi đột biến EGFR
Giảm khối u càng sâu, sống càng lâu: Đột phá trong điều trị ung thư phổi EGFR bằng thuốc nhắm trúng đích
Thuốc đích EGFR trong điều trị ung thư phổi giai đoạn 4: Thời gian lui bệnh và ý nghĩa lâm sàng
Hiệu quả thuốc đích Osimertinib trong điều trị di căn gan ung thư phổi đột biến EGFR+ giai đoạn 4
THUỐC ĐÍCH ĐIỀU TRỊ UNG THƯ PHỔI VÀ CÁC THUỐC MỚI VƯỢT QUA CÁC ĐỘT BIẾN KHÁNG THUỐC
Ung thư phổi vẫn là nguyên nhân hàng đầu gây tử vong trên thế giới, xếp trên ung thư vú, tiền liệt tuyến, đại trực tràng và sọ não. Ung thư phổi không tế bào nhỏ (UTPKTBN) chiếm hơn 2/3 ca bệnh với khoảng 84% ở giai đoạn tiến triển chẩn đoán. Các loại đột biến gen được khuyến cáo thực hiện gồm: EGFR, ALK, ROS1, MET, RET, BRAF, KRAS. Thuốc đích điều trị các đột biến này đã giảm tỉ lệ tử vong từ 35% năm 2001 còn 26% năm 2014. Tuy nhiên vấn đề kháng thuốc và tiến triển bệnh khi dùng các thuốc đích trên là một vấn đề lớn, điều này dẫn tới việc nghiên cứu các thế hệ thuốc mới để vượt qua sự kháng thuốc.
Các marker dự báo trong ung thư phổi
Marker dự báo đáp ứng điều trị trong UTPKTBN gồm các loại đột biến gen sau: ALK, ROS1, EGFR, BRAF V600E, NTRK, MET, RET.
Thuốc ức chế EGFR
Đột biên EGFR exo19del và L858R chiếm phần lớn đột biến EGFR. Osimertinib hiện là điều trị chuẩn cho các trường hợp chưa điều trị thuốc đích trước đây. Ngoài ra còn có các thuốc thế hệ 1, 2 như: erlotinib, gefitinib, afatinib.
Kháng thuốc EGFR TKIs
Cơ chế kháng thuốc thế hệ 1, 2: đột biến T790M (57%), các đột biến HER2, MET, SCLC, PI3KCA, BRAF, EMT, cơ chế hỗn hợp. Cơ chế kháng thuốc đích osimertinib: mất T790M và đột biến kích hoạt (45%), C797S, khuếch đại EGFR, khuếch đại MET, đột biến PI3KCA, KRAS, HER2, SCLC, FGFR
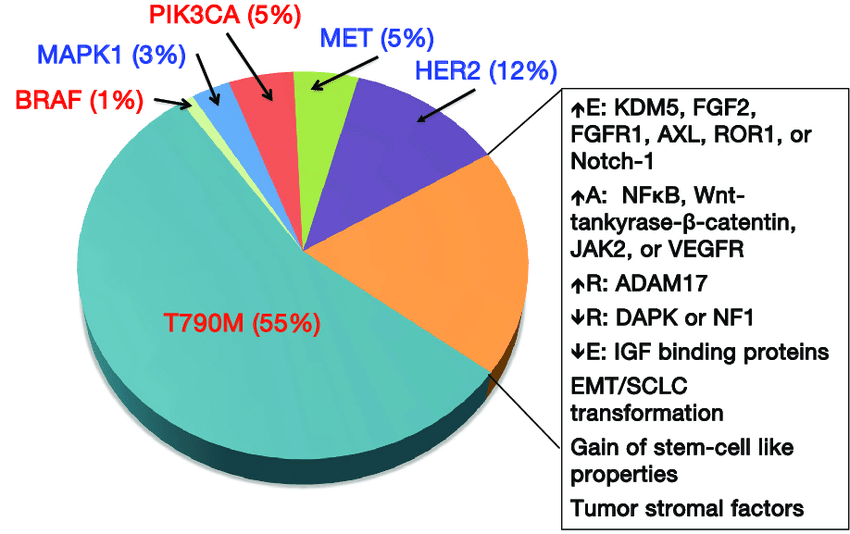
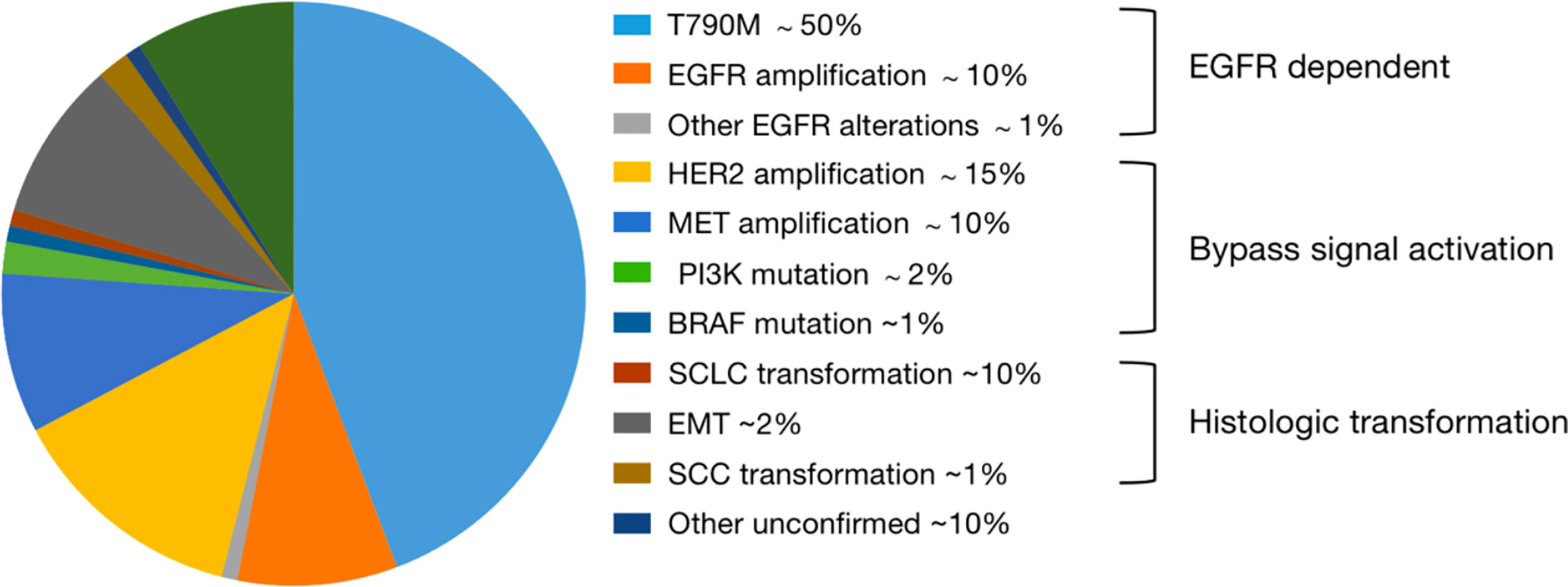
Hiện nay chưa có thuốc đích nào điều trị sau khi kháng osimertinib. Điều trị hóa chất hoặc hóa chất miễn dịch là lựa chọn sau kháng osimertinib. Rất nhiều nghiên cứu đang tiến hành để tìm hướng điều trị mới như: nghiên cứu pha 2 ORCHARD dựa trên sự kháng osimertinib để chọn thuốc đích phù hợp nhất điều trị, thử nghiệm CHECMATE 722 đánh giá nivolumab kết hợp hóa chất hoặc ipilimumab kết hợp hóa chất ở nhóm có đột biến EGFR, T790M âm tính và bệnh tiến triển sau thuốc đích EGFR TKIs; thử nghiệm KEYNOTE 789 pha 3 đánh giá hóa chất kết hợp pembrolizumab ở nhóm kháng thuốc đích.
Phát triển thuốc đích thế hệ 3
Ngoài osimertinib một số thuốc đích thế hệ 3 được nghiên cứu như lazertinib, olmutinib, nazartinib.
Lazertinib cho tỉ lệ đáp ứng 57.9% và tỉ lệ kiểm soát bệnh 89.5% ở nhóm kháng thuốc thế hệ 1, 2 và có đột biến T790M. PFS đạt 11 tháng và DOR trung bình đạt 15.2 tháng. ADR chính là nổi ban, ngứa, dị cảm.
Olmutinib được thử nghiệm pha 2 ở bệnh nhân có đột biến T790M đã thất bại với 1 hoặc nhiều thuốc đích. Tỉ lệ đáp ứng đạt 46.3%, tỉ lệ kiểm soát bệnh đạt 86.4%, thời gian đáp ứng trung bình 12.7 tháng, PFS trung bình 9.4 tháng và OS trung bình 19.7 tháng.
Nazartinib được thử nghiệm ở bệnh nhân chưa điều trị đạt tỉ lệ đáp ứng 69% với PFS trung bình 18 tháng, OS trung bình chưa đạt ở thời điểm 33 tháng với 56% bệnh nhân còn sống. Nazartinib hiện đang được thử nghiệm kết hợp gefitinib và trametinib.
Aflutinib được đánh giá ở bệnh nhân tiến triển sau thuốc đích thế hệ 1, 2 hoặc đột biến T790M tiên phát. Tỉ lệ đáp ứng đạt 73.6% với PFS trung bình 7.6 tháng.
Thuốc đích EGFR thế hệ kế tiếp
Thuốc đích thế hệ 4 gồm EAI045 và BLU-945 đang được đánh giá để vượt qua đột biến C797S là dạng đột biến kháng thuốc hay gặp nhất kháng lại osimertinib. EAI045 kháng lại đột biến T790M và C797S đã thể hiện hiệu quả khi kết hợp cetuximab nghiên cứu trên chuột. BLU-945 kháng 3 đột biến L858R/exon19del và đột biến T790M, C797S, thuốc đang được thử nghiệm ở bệnh nhân đã dùng ít nhất 1 loại thuốc đích.
BDTX-189 là thuốc đích ức chế không đảo ngược kháng lại đột biến EGFR, HER2, ERBB. Các dữ liệu an toàn và hiệu quả được thể hiện qua thử nghiệm Mastery key-01.
CLN-081 (TAS6417) có thể ức chế đột biến exon19del, L858R, T790M, G719X, L861Q, S768I và exon20ins. Thuốc đang được thử nghiệm ở bệnh nhân có đột biến hiếm exon20ins.
DZD9008 là thuốc ức chế đột biến EGFR và HER2 exon20ins và một số đột biến khác. 2 thử nghiệm thuốc đang được tiến hành ở bệnh nhân có đột biến EGFR và HER2 exon20ins.
Tarloxotinib là tiền chất của chất ức chế pan-ERBB kinase. Thử nghiệm RAIN-701 thuốc tarloxotinib ở bệnh nhân có đột biến exon20ins hoặc HER2 và bệnh tiến triển sau hóa chất có platinum, tỉ lệ kiểm soát bệnh đạt 60%. Thuốc đang tiếp tục được đánh giá qua các thử nghiệm.
Amivantamab là kháng thể kháng EGFR và MET. Thuốc đã được FDA chấp thuận điều trị đột biến exon20ins, tỉ lệ đáp ứng đạt 36%, tỉ lệ lợi ích lâm sàng là 67%, mPFS đạt 8.3 tháng và thời gian đáp ứng là 10 tháng.
Poziotinib là thuốc đích đối kháng exon20ins. Trong thử nghiệm ZENITH20 thể hiện hoạt tính ở bệnh nhân có đột biến EGFR hoặc HER2 exon20, tỉ lệ đáp ứng 22.2%, tỉ lệ kiểm soát bệnh 88.9%.
Mobocertinib là thuốc đích nhắm EGFR exon20ins. Trong thử nghiệm EXCLAIM tỉ lệ đáp ứng đạt 28%, tỉ lệ kiểm soát bệnh 78% và thời gian đáp ứng trung bình là 17.5 tháng.

Thuốc đích EGFR điều trị kết hợp
Amivantamab được so sánh đơn trị và kết hợp với lazertinib hoặc hóa chất ở bệnh nhân có đột biến EGFR hoặc đột biến/khuếch đại MET. Các dữ liệu đáp ứng sơ bộ đạt được ở nhóm tái phát sau thuốc đích thế hệ 3 gồm đột biến C797S, khuếch đại MET, exon20ins. Về đáp ứng sau tái phát osimertinib của amivantamab+lazertinib có tỉ lệ đáp ứng 36%, sau 8.2 tháng theo dõi có 44% bệnh nhân vẫn đang điều trị, mPFS đạt 4.9 tháng.
Osimertinib kết hợp savolitinib (ức chế MET) được thử nghiệm ở nhóm đột biến khuếch đại MET, EGFR và bệnh tiến triển sau thuốc đích, kết quả nhiều hứa hẹn về lợi ích. Kết hợp osimertinib và dacomitinib được hi vọng chống lại các đột biến EGFR mắc phải. Thử nghiệm INSIGHT 2 kết hợp osimertinib và tepotinib điều trị đột biến mắc phải kháng osimertinib bước 1 do khuếch đại MET.
Tác dụng hiệp đồng giữa thuốc đích EGFR và thuốc ức chế VEGFR qua thử nghiệm RELAY khi kết hợp ramucirumab+erlotinib và erlotinib đơn thuần với PFS trung bình đạt 19.4 tháng so với 12.4 tháng. FDA chấp thuận kết hợp điều trị này cho đột biến EGFR. Kết hợp giữa osimertinib và ramucirumab đang được nghiên cứu, kết quả sơ bộ thấy tỉ lệ đáp ứng 76%, thời gian đáp ứng trung bình 13.4 tháng, PFS trung bình 11 tháng.
Thuốc ức chế ALK
Đột biến tái sắp xếp ALK gặp 3-7%. Crizotinib là thuốc đầu tiên được chấp thuận điều trị, sau đó ceritinib, alectinib, brigatinib, lorlatinib được chấp thuận điều trị.
Brigatinib bước 1 so sánh với crizotinib qua thử nghiệm ALTA-1L, brigatinib vượt trội về PFS với 24 so với 11 tháng, brigatinib dễ dung nạp hơn crizotinib. Lorlatinib bước 1 so với crizotinib qua thử nghiệm CROWN. Tỉ lệ đáp ứng là 76% và 58%. Tỉ lệ bệnh không tiến triển 12 tháng là 78% và 39%.
SAF-189 là thuốc ức chế ALK mới với khả năng xâm nhập hệ thần kinh. Trong thử nghiệm pha 1, 2 với đột biến ALK, tỉ lệ đáp ứng 1 phần đạt 50%.
TQ-B3101 là thuốc ức chế ALK, ROS1, MET. Trong thử nghiệm pha 1 cho tỉ lệ đáp ứng 87.5%, với di căn não có đáp ứng 62.5%. Hiện nay TQ-B3101 đang được thử nghiệm ở nhóm tiến triển sau crizotinib.
TPX-0131 là thuốc đích ALK thế hệ kế tiếp có thể vượt qua các đột biến kháng thuốc ALK đặc biệt là đột biến SFM G1202R và L1196M/G1202R. TPX-0131 mạnh gấp hơn 100 lần chống lại G1202R so với lorlatinib. Thuốc đang được thử nghiệm ở pha 1/2 đột biến ALK.
Hiệu quả và an toàn của crizotinib kết hợp bevacizumab ở bệnh nhân đột biến ALK/ROS1/MET đang được thử nghiệm, PFS và DOR ở nhóm ALK đạt 13.9 và 14.8 tháng.
Brigatinib kết hợp bevacizumab và alectinib kết hợp cobimetinib đang được đánh giá.
Thuốc ức chế MET
Gen MET có vai trò trong quá trình sống sót và biệt hóa tế bào. Đột biến MET thường gặp là đột biến điểm 14 skipping, khuếch đại gen MET hoặc quá bộc lộ protein MET. Đột biến MET kém đáp ứng với thuốc miễn dịch kể cả khi PDL1 cao. Hiện có 2 thuốc đích được chấp thuận điều trị.
FDA chấp thuận capmatinib điều trị bước 1 đột biến MET exon14 skipping dựa trên thử nghiệm GEOMETRY, capmatinib cũng có hiệu quả với khuếch đại MET ở bệnh nhân mới. PFS trung bình 10.8 tháng và OS trung bình 20.8 tháng.
Tepotinib ức chế MET được đánh giá qua thử nghiệm VISION, tỉ lệ đáp ứng 46%, thời gian đáp ứng trung bình 11.1 tháng, tepotinib có hiệu quả cả ở nhóm di căn não và đã được FDA chấp thuận điều trị.
Glumetinib ức chế chọn lọc MET dễ dung nạp ở đột biến MET với mức tiều tới 400mg/ngày. Thử nghiệm pha 1 đang được tiến hành.
APL-101 ức chế chọn lọc con đường giáng hóa c-MET. Thử nghiệm pha ½ với đột biến exon14 skipping và giáng hóa c-met đang được tiến hành.
Thuốc ức chế gen RET
Tái sắp xếp gen RET gặp ở 1-2% bệnh nhân ung thư biểu mô tuyến và ko trùng lặp với EGFR, ALK, RAS. Đột biến RET có nguy cơ cao di căn não. Selpercatinib và pralsetinib được FDA chấp thuận điều trị.
Selpercatinib (LOXO-292) là thuốc ức chế RET kinase. Thử nghiệm pha 2 cho tỉ lệ đáp ứng 64% với thời gian đáp ứng trung bình 17.5 tháng. Với bệnh nhân chưa điều trị tỉ lệ đáp ứng tới 85% và 90% có đáp ứng sau 6 tháng. Tỉ lệ đáp ứng nội sọ là 91%. Thử nghiệm pha 3 so sánh salpercatinib với điều trị bước 1 đang được tiến hành.
Pralsetinib được FDA chấp thuận điều trị dựa trên thử nghiệm pha 1/2 ARROW. Tỉ lệ đáp ứng và kiểm soát bệnh ở nhóm đã điều trị hóa chất platinum là 62% và 91%. PFS trung bình là 16.5 tháng. Thử nghiệm pha 3 đang tiến hành.
TPX-0046 là thuốc đích thế hệ tiếp có thể vượt qua đột biến kháng thuốc như SFMs, thử nghiệm pha 1/2 ở bệnh nhân kháng thuốc và bệnh nhân chưa điều trị đang tiến hành.
BOS172738 là thuốc ức chế chọn lọc RET, có hiệu quả >300 lần VEGFR2. Thử nghiệm pha 1 cho thấy dữ liệu an toàn ở 67 bệnh nhân có đột biến RET và tỉ lệ đáp ứng khoảng 30%.
Thuốc ức chế BRAF/MEK
Dabrafenib ức chế đột biến BRAF V600E và trametinib ức chế MEK. Kết hợp dabrafenib/trametinib được FDA chấp thuận điều trị bước 1 cho đột biến BRAF V600E.
LXH254 là thuốc ức chế BRAF và CRAF. LXH254 dạng uống cho thấy dung nạp tốt và hoạt tính kháng u trong thử nghiệm pha 1 ở bệnh nhân có đột biến con đường tín hiệu MAPK. Thuốc đang được thử nghiệm pha 1B kết hợp LTT462 (thuốc ức chế ERK1/2), trametinib (ức chế MEK) và ribociclib (ức chế CDK4/6) ở bệnh nhân đột biến KRAS hoặc BRAF.
ABM-1310 là thuốc ức chế phân tử nhỏ BRAF được đánh giá trong thử nghiệm pha 1 ung thư phổi có đột biến BRAF V600E.
Thuốc ức chế ROS1
Đột biến ROS1 gặp 1-2% bệnh nhân. Crizotinib, entrectinib, ceritinib được khuyến cáo điều trị bước 1 với nhóm đột biến này.
Entrectinib là thuốc ức chế cả ROS1 và TRK. Trong thử nghiệm cho thấy entrectinib đạt tỉ lệ đáp ứng 77%, tỉ lệ đáp ứng nội sọ 55%.
Lorlatinib là thuốc đích thế hệ 3 kháng ALK và ROS1. Thử nghiệm pha 1/2 cho thấy tỉ lệ đáp ứng ở nhóm chưa điều trị đạt 62% và nhóm đã dùng crizotinib đạt 35%. Tỉ lệ đáp ứng nội sọ khoảng 50-60%.
Repotrectinib là thuốc đích thế hệ kế tiếp ức chế ROS1/TRK với >90 lần crizotinib chống lại ROS1. Dữ liệu tiền lâm sàng thấy repotrectinib kháng được đột biến kháng thuốc ROS1 gồm SFM G2032R. Trong thử nghiệm pha 1 repotrectinib dung nạp tốt và đáp ứng 91% ở nhóm chưa điều trị; 100% đáp ứng nội sọ ở nhóm chưa điều trị và 75% ở nhóm đã dùng thuốc đích. Thử nghiệm pha 2 TRIDENT-1 đang tiến hành.
Taletrectinib (AB-10) là thuốc ức chế ROS1/NTRK. Trong thử nghiệm pha 1 taletrectinib cho đáp ứng 66.7% và PFS trung bình 29.1 tháng. Dữ liệu nghiên cứu pha 2 TRUST taletrectinib ở đột biến ROS1 cho thấy tỉ lệ đáp ứng ở nhóm chưa điều trị crizotinib đạt 100%.
Thuốc ức chế đột biến trộn lẫn gen NTRK
Trộn gen NTRK gặp khoảng 0.1% ung thư phổi không tế bào nhỏ. Larotrectinib và entrectinib được FDA chấp thuận điều trị bước 1 hoặc bước sau cho đột biến này.
Larotrectinib là thuốc ức chế TRK. Tỉ lệ đáp ứng khoảng 75%, thử nghiệm pha 2 đang tiến hành.
Entrectinib cũng được đánh giá ở bệnh nhân ROS1 trong thử nghiệm pha 1 và 2. Tỉ lệ đáp ứng đạt 70% với hầu hết bệnh nhân điều trị 1 hoặc nhiều bước. Thử nghiệm pha 2 với đột biến NTRK và ROS1 đang tiến hành.
Thử nghiệm mở rộng pha 2 TRIDENT-1 đánh giá repotrectinib đang tiến hành với đột biến tái sắp xếp TRK.
Gen NTRK1 mã hóa protein TrKA. Điều hòa tăng TrKA có thể do trộn lẫn gen NTRK hoặc quá bộc lộ protein TrKA không hoàn chỉnh gây ra sinh ung thư trong ung thư phổi. VMD-928 là thuốc đích ức chế chọn lọc TrKA đầu tiên được thử nghiệm pha 1 với khoảng liều 300-2400mg/ngày.

Thuốc ức chế KRAS
Đột biến KRAS thường gây kháng thuốc đích và tiên lượng kém. Đột biến G12C gặp khoảng 13% ung thư phổi.
Sotorasib (AMG510) là thuốc ức chế G12C. Trong thử nghiệm pha 2, sotorasib liều 960mg/ngày ở bệnh nhân đã điều trị bước 1. Tỉ lệ đáp ứng đạt 37.1%, thời gian đáp ứng trung bình 11.1 tháng, tỉ lệ kiểm soát bệnh 80.6%. PFS trung bình 6.8 tháng, OS trung bình 12.5 tháng. Độc tính gặp ở 69.8% bệnh nhân với độc tính độ 3 ở 19.8%, độ 4 ở 0.8% bệnh nhân. Độc tính hay gặp nhất là tiêu chảy 37.1%, buồn nôn 19%, tăng men gan 15.1%, mệt mỏi 11.1%. Hiệu quả của sotorasib thấy ở cả đột biến STK11 và KEAP1. Sotorasib đang được thử nghiệm so sánh docetaxel trong thử nghiệm pha 3.
Adagrasib (MRTX-849) là thuốc ức chế G12C hiện đang được đánh giá trong thử nghiệm pha 1/2. Trong thử nghiệm Krystal-1, adagrasib liều 600mg x 2 lần/ngày; chỉ có 3% gặp độc tính nặng độ 3/4 hạ natri máu, tỉ lệ đáp ứng đạt 45%, tỉ lệ kiểm soát bệnh đạt 96%. Thử nghiệm KRYSTAL-12 so sánh adagrasib với docetaxel ở nhóm G12C đã điều trị đang được tiến hành.
Các thuốc ức chế KRAS khác đang được thử nghiệm ở pha 1/2 gồm: GDC-6036, D-1553, Rigosertib.
Thuốc kháng thể liên hợp
Thuốc kháng thể liên hợp ADCs là các tác nhân kết hợp phần gây độc tế bào với một kháng thể đơn dòng tác động đích tế bào ung thư.
Patritumab-deruxtecan (HER3-Dxd/U3-1402) là ADC đích HER-3 với 1 kháng thể đơn dòng liên hợp với phần ức chế topoisomerase I, thuốc thể hiện sự an toàn và hoạt tính kháng u trong thử nghiệm. Với liều 5.6mg/kg IV Q3W với thời gian theo dõi 10.2 tháng đạt tỉ lệ đáp ứng 39% và kiểm soát bệnh 72%. Thời gian DOR 6.9 tháng và PFS trung bình 8.2 tháng. Hoạt tính kháng u thấy cả ở những cơ chế kháng thuốc EGFR khác nhau và không liên quan HER3 (C797S, MET, HER2, BRAF).
Cofetuzumab pelidotin (ABBV-647) là kháng thể liên hợp kháng PTK7 gồm kháng thể đơn dòng hu6MO24 và Aur0101 (ức chế vi ống auristatin). PTK7 thường quá bộc lộ trong nhiều loại ung thư trong đó có UTPKTBN. Thử nghiệm pha 1 thế hiện hoạt tính kháng u và an toàn trong UTPKTBN. Tỉ lệ kiểm soát bệnh đạt 56%. Thử nghiệm pha 1B đánh giá an toàn và dung nạp đang tiến hành.
Glycoprotein CEACAM5 thường quá bộc lộ trong UTPKTBN. SAR408701 là ADC đích CEACAM5 được thử nghiệm với 2 mức bộc lộ CEACAM5 là mức trung bình CEACAM5 từ 1-50% và mức cao >=50%, tỉ lệ đáp ứng tương ứng là 7.1% và 20.3%, độc tính độ 3 ở 47.8%. Thử nghiệm pha 3 đang tiến hành.
TROP2 có sự quá bộc lộ trong ung thư phổi và giảm sống sốt. DS-1062 (datopotamab-deruxtecan) là kháng thể đơn dòng gắn vào phần ức chế topoisomerase I. Kết quả thử nghiệm pha 1 TROPION-Pantumor01 cho thấy tỉ lệ đáp ứng 21% và tỉ lệ kiểm soát bệnh 67%, PFS trung bình 8.2 tháng với dữ liệu an toàn liều lượng 6mg/kg. Độc tính hay gặp nhất là buồn nôn 50%, viêm dạ dày 44%, rụng tóc 40%, mệt mỏi 33%. Thử nghiệm pha 3 với thuốc DS-1062 đang tiến hành để so sánh với docetaxel ở bệnh nhân đã điều trị và không có đột biến gen.
Thuốc ức chế PI3K/AKT/mTORC
Con đường PI3K/AKT/mTOR đóng vai trò quan trọng trong sinh u và tiến triển ung thư phổi. Đột biến PI3KCA gặp khoảng 3.7% bệnh nhân, gặp nhiều hơn ở nhóm ung thư biểu mô vảy. Sự tăng điều hòa con đường mTOR gặp ở 90% biểu mô tuyến so với 40% biểu mô vảy.
Sapanisertib (TAK228) là thuốc ức chế TORC1/2, trong thử nghiệm pha 2 thuốc đã thể hiện hiệu quả ở đột biến NFE2L2 đáp ứng 20% và đột biến KEAP1 đáp ứng 17%. Độc tính chính gồm tăng glucose máu 72%, mệt mỏi 32%, tiêu chảy 32% và giảm ngon miệng 32%.
Sirolimus gắn FKBP-12 là protein nội bào hình thành phức hợp ức chế miễn dịch ức chế mTOR. Thuốc được đánh giá trong nghiên cứu pha 1/2 với auranofin ở bệnh nhân ung thư phổi tiến triển tái phát chưa điều trị. Tiêu chí đánh giá gồm: liều tối đa auranofin, số lượng và mức độ độc tính, PFS.
TÀI LIỆU THAM KHẢO
Rivera-Concepcion J, Uprety D, Adjei AA. Challenges in the Use of Targeted Therapies in Non-Small Cell Lung Cancer. Cancer Res Treat. 2022 Apr;54(2):315-329. doi: 10.4143/crt.2022.078. Epub 2022 Feb 18. PMID: 35209703; PMCID: PMC9016301.
Để biết thêm chi tiết xin liên hệ:
- Ths.Bs. Trần Khôi.
- Bệnh viện Phổi Hà Nội
- 44 Thanh Nhàn, Hai Bà Trưng, Hà Nội
- Hotline: 0983 812 084, 0913 058 294
- CHỮA BỆNH UNG THƯ PHỔI: https://www.facebook.com/groups/894940984347355
- YouTube: https://www.youtube.com/channel/UCjueL8VycYzFjGkVcglHV2g




