SỰ KHÁNG THUỐC OSIMERTINIB VÀ HƯỚNG ĐIỀU TRỊ
08:23 - 19/01/2023
Sự kháng thuốc đích thế hệ 3 Osimertinib và các hướng điều trị hứa hẹn trong tương lai.
KHÁNG THUỐC OSIMERTINIB VÀ HƯỚNG ĐIỀU TRỊ MỚI
Mặc dù có hiệu quả cao nhưng sự kháng thuốc với osimertinib tương tự như các thế hệ thuốc khác, do đó giới hạn lợi ích lâm sàng của thuốc. Hơn nữa có thể xuất hiện kháng osimertinib khi điều trị các thuốc đích khác.
Tính không đồng nhất của ung thư phổi ảnh hưởng lớn tới sự kháng osimerti
Khối u giảm càng nhiều, sống càng lâu: Giá trị tiên lượng trong điều trị ung thư phổi đột biến EGFR
Giảm khối u càng sâu, sống càng lâu: Đột phá trong điều trị ung thư phổi EGFR bằng thuốc nhắm trúng đích
Thuốc đích EGFR trong điều trị ung thư phổi giai đoạn 4: Thời gian lui bệnh và ý nghĩa lâm sàng
Hiệu quả thuốc đích Osimertinib trong điều trị di căn gan ung thư phổi đột biến EGFR+ giai đoạn 4
KHÁNG THUỐC OSIMERTINIB VÀ HƯỚNG ĐIỀU TRỊ MỚI
Mặc dù có hiệu quả cao nhưng sự kháng thuốc với osimertinib tương tự như các thế hệ thuốc khác, do đó giới hạn lợi ích lâm sàng của thuốc. Hơn nữa có thể xuất hiện kháng osimertinib khi điều trị các thuốc đích khác.
Tính không đồng nhất của ung thư phổi ảnh hưởng lớn tới sự kháng osimertinib với nhiều cơ chế kháng khác nhau. Ngoài ra sự thay đổi nhiều phân tử đã thấy khi osimertinib điều trị bước 1 hoặc bước sau, do đó sinh thiết lại hoặc xét nghiệm mẫu máu là bước quan trọng tiếp theo sau kháng osimertinib. Sự kháng osimertinib có thể chia thành 2 nhóm phụ thuộc và không phụ thuộc EGFR.
1. SỰ ĐỀ KHÁNG PHỤ THUỘC EGFR
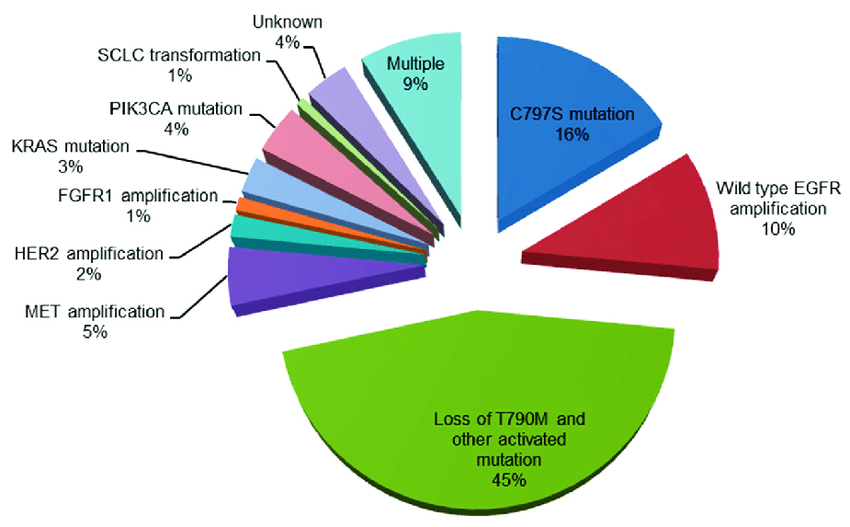
Theo số liệu xét nghiệm huyết tương trong thử nghiệm AURA3 thì sau khi tiến triển với osimertinib có đột biến EGFR mới trong đó C797S hay gặp nhất (14%), tất cả mẫu có đột biến EGFR tiếp theo đều bảo tồn T790M sau tiến triển osimertinib. Mặc dù vậy có 49% mất T790M khi tiến triển sau osimertinib.
Với nhóm mất T790M thì exon19del chiếm ưu thế 83% sau là L858R 14%. Mất T790M là cơ chế kháng osimertinib bước 2 và hay gặp các đột biến kháng đối kháng như KRAS, khuếch đại MET và chuyển dạng tế bào nhỏ, trộn lẫn gen.
Oxnard và cộng sự nghiên cứu sự mất T790M sau kháng osimertinib bước 2 thấy sự mất T790M dẫn tới kháng sớm osimertinib và giảm thời gian đến khi ngừng điều trị (6.1 tháng vs 15.2 tháng). Các nghiên cứu tiếp theo cho thấy sự ảnh hưởng xấu của mất T790M tới PFS và OS. Ngoài ra nồng độ T790M huyết tương và đột biến hoạt hóa có thể dự báo cơ chế kháng.
Trong thử nghiệm FLAURA, xét nghiệm huyết tương nhóm dùng osimertinib bước 1 cho thấy không có đột biến T790M, điều này cho thấy osimertinib hiệu quả với EGFR và T790M và sự xuất hiện T790M không phải cơ chế kháng osimertinib. Các cơ chế kháng phụ thuộc EGFR gồm xuất hiện đột biến thứ 3 hoặc khuếch đại EGFR, hay gặp ở những ca bệnh bảo tồn T790M.
1.1. Đột biến C797
Đột biến thứ 3 hay gặp nhất là C797S ở exon20, chiếm 10-26% kháng osimertinib bước 2. Khi osimertinib điều trị bước 1 thì C797S gặp khoảng 7% chiếm vị trí thứ 2 sau khuếch đại MET trong sự kháng osimertinib. Đột biến C797S gây kháng chéo với các thuốc thế hệ 3 khác như rociletinib, olmutinib và narzatinib bằng cách ngăn gắn với vị trí hoạt hóa EGFR.
Quan trọng hơn là đặc điểm allen của C797S có thể ảnh hưởng điều trị. Nếu C797S ở vị trí trans với T790M thì tế bào có thể làm đích cho thuốc thế hệ 1, 3 hướng tới các allen C797S và T790M. Còn nếu C797S ở cis với T790M thì thường kháng với thuốc đích kể cả kết hợp.
Yang và cộng sự nghiên cứu mẫu huyết tương ở 93 bệnh nhân dùng osimertinib bước 2. Kết quả thấy đột biến thứ 3 gây kháng osimertinib gặp ở 1/3 trường hợp với 24% là C797S và 2 ca có C797G và đột biến khác.
1.2. Đột biến G796
Đột biến hòa tan với G796 gồm: G796R, G796S và G796D kế cận C797 có thể gây đối kháng không gian với osimertinib. G796R ảnh hưởng chính và G796S ảnh hưởng ít tới sự gắn osimertinib.
1.3. Đột biến L792, L718 và G719
Protein EGFR kinase có thùy NH2 (thùy N) và thùy tận cùng COOH lớn hơn được kết nối bởi vùng bản lề kinase. Đột biến L792 ở vùng này có thể gây đối kháng không gian và giảm sự gắn của osimertinib. Đột biến L792 hay đi cùng đột biến EGFR khác và xảy ra dạng cis với T790M và trans với G796/C797 khi cùng xuất hiện ở 1 người bệnh. Hơn nữa L792 vẫn nhạy cảm với gefitinib invitro.
Đột biến L718 cũng gây kháng osimertinib invitro và invivo. Hầu hết là L718Q và phần lớn không kèm đột biến C797, điều này gợi ý L718 có thể gây kháng độc lập osimertinib. L718 nằm ở vùng gắn ATP của EGFR kinase và đột biến ở vùng này gây hạn chế và ẩn giấu vùng gắn với osimertinib.
Đột biến G719A có thể gây hạn chế không gian và kháng osimertinib do phần còn lại gắn với L718. Mặc dù vậy invitro thì L718 vẫn nhạy với thuốc đích thế hệ 1, 2 và được xác nhận lâm sàng đặc biệt với nhóm mất T790M. Chú ý đột biến EGFR L718Q kháng osimertinib bước 1 gặp khoảng 2% ca bệnh.
1.4. Đột biến G724
Đột biến G724S trong vòng P của EGFR kinase thấy ở nhiều bệnh nhân tiến triển osimertinib. Đột biến G724S gây biến đổi cấu trúc receptor và giảm gắn osimertinib. Do là đột biến ít gặp nên G724S được cho là hay gặp với exon19del hơn L858R. Quan trọng hơn là thuốc đích thế hệ 2 afatinib vẫn còn hoạt tính với G724S.
1.5. Đột biến exon20
Đột biến ở exon20 có thể có sau tiến triển osimertinib. Đột biến S768I hiếm gặp ở exon20 có liên kết với EGFR nhạy thuốc ở thời điểm bắt đầu điều trị đích (<1% ca bệnh). S768I đã gặp ở osimeritnib bước 2 và tiến triển sau osimertinib bước 1. Đột biến cài exon20ins cũng gặp ở bệnh nhân điều trị osimertinib.
1.6. Khuếch đại EGFR
Trong điều trị bước 2, sự khuếch đại allen EGFR wt cùng với exon19del là cơ chế kháng osimertinib mới. Kim và cộng sự thấy tăng bộc lộ EGF mRNA ở mô u ở bệnh nhân tiến triển sau osimertinib.
2. SỰ ĐỀ KHÁNG KHÔNG PHỤ THUỘC EGFR
Sự kháng osimertinib có thể qua các con đường tín hiệu khác hoặc tín hiệu dòng sai lạc hoặc chuyển dạng mô học. Quan trọng hơn các sai lạc này có thể cùng xảy ra trong mô u và kèm với đột biến thứ 3 EGFR.
2.1. Khuếch đại MET
Khuếch đại MET là nguyên nhân hay gặp nhất của sự hoạt hóa đường vòng gây kháng thuốc đích. Điều này gây kháng osimertinib bởi sự hoạt hóa dai dẳng tín hiệu dòng của EGFR như trung gian bởi MAPK, STAT, PI3K-Akt, hoạt hóa độc lập EGFR.
Khuếch đại MET có thể đồng thời với sự có hoặc không mất T790M khi điều trị osimertinib bước 2. Lúc này mất T790M ở 43% và bảo tồn ở 57%. Trong AURA3, khuếch đại MET ở 19% khi bệnh tiến triển và/hoặc dừng điều trị. Quan trọng hơn khuếch đại MET đồng thời với C797S ở 7% ca và cũng có khả năng kèm khuếch đại CDK6 và BRAF.
Khi osimertinib điều trị bước 1, khuếch đại MET là nguyên nhân kháng hay gặp với 15% khi giải trình tự DNA huyết tương. Tỉ lệ này có thể cao hơn ở mẫu mô. Một vài nghiên cứu kết hợp thuốc ức chế c-MET như crizotinib với osimertinib có thể vượt qua được dòng tế bào kháng osimertinib với khuếch đại MET. Đột biến MET exon14 skipping có thể gặp và các đột biến khác như MET-P97Q và I865F.
2.2. Khuếch đại HER2
Khuếch đại HER2 gặp ở 5% kháng osimertinib bước 2 và loại trừ lẫn nhau với đột biến T790M. Đột biến HER2 có thể kèm khuếch đại EGFR L792X+C797X+PIK3CA, EGFR G796S+MET, PIK3CA. Với osimertinib bước 1 thì đột biến HER2 gặp ở 2% bệnh nhân.
2.3. Hoạt hóa con đường RAS-MAPK
Sự sai lạc RAS-MAPK sẽ gây kháng osimertinib ở bệnh nhân đột biến EGFR. Eberlain và cộng sự phát hiện đột biến NRAS mới là E63K ở dòng tế bào kháng osimertinib kèm theo tăng bản sao NRASwt và KRASwt kháng cả gefitinib, afatinib.
Kết hợp osimertinib với thuốc kháng MEK selumetinib được cho là phòng sự đề kháng thuốc đích ở invitro và invivo. Tác giả Ortiz-Cuẩn phát hiện đột biến KRAS G12C ở mẫu sinh thiết lại sau kháng osimertinib, các đột biến KRAS khác như G12D, Q61R và Q61K cũng được phát hiện. G12D phát hiện sau kháng osimertinib cả bước 1 và bước sau. G12D tồn tại từ đầu kết hợp với mất PTEN phát hiện ở bệnh nhân kháng tiên phát với osimertinib bước 2.
Trong con đường RAS-MAPK, đột biến BRAF V600E gây kháng osimertinib khoảng 3% cả bước 1 và bước sau và có/không T790M khi osimertinib dùng sau thất bại với thuốc đích khác. Quan trọng hơn dòng tế bào BRAF V600E kháng osimertinib nhưng nhạy với kết hợp encorafenib và osimertinib.
2.4. Hoạt hóa con đường PI3K
Hoạt hóa vòng con đường PI3K xảy ra qua đột biến/khuếch đại PI3K và mất PTEN. Xuất hiện đồng thời đột biến PI3K cho là tiên lượng xấu, không có sự khác biệt tiên lượng nếu điều trị với thuốc đích EGFR đơn trị. Trong đột biến PI3K thì E545K, E542K, R88Q, N345K, E418K gặp 4-11% kháng osimertinib bước 2.
2.5. Thay đổi chu trình tế bào
Sự thay đổi các protein chu trình tế bào gặp ở 12% và 10% tiến triển sau osimertinib bước 2 và bước 1, và có tiên lượng xấu sau osimertinib. Khuếch đại gen mã hóa cyclin D1, cyclin D2, cyclin E1, kinase phụ thuộc cyclin CDK4 và CDK6.
2.6. Trộn lẫn gen
Trộn lẫn gen gây ra ung thư gặp 3-10% ca bệnh kháng osimertinib bước 2 và có thể kèm với đột biến EGFR C797S, BRAF, MET. Các trộn gen gồm: FGFR3-TACC3, RET-ERC1, CCD6-RET, NTRK1-TMP3, NCOA4-RET, GOPC-ROS1, AGK-BRAF, ESYT2-BRAF có khả năng gây kháng osimertinib bước 2.
Quan trọng hơn là kết hợp osimertinib với thuốc ức chế RET BLU-667 vượt qua được đột beiens CCD6-RET. Nghiên cứu khác thấy đột biến trộn lẫn tyrosine kinase và BRAF kinase gây kháng thuốc đích gồm PLEKHA7-ALK. Sau cùng đột biến EML4-ALK được xác nhận sau tiến triển osimertinib bước 2, lúc đó criotinib+osimertinib có thể ổn định bệnh.
2.7. Biến đổi mô bệnh học
Chuyển dạng tế bào nhỏ gặp 4-15% ca bệnh kháng thuốc thế hệ 1, gây giảm sống sót và kháng thế hệ 3. Theo các nghiên cứu có sự bất hoạt các gen EB1 và TP53 trong mẫu mô ung thư phổi không tế bào nhỏ ban đầu, điều này có thể là yếu tố dự báo chuyển dạng tế bào nhỏ. Sự kiện này cũng có thể gặp khi kháng thuốc thế hệ 3 osimertinib.
Việc đánh giá RB1 và TP53 và mức NSE ở mẫu huyết tương ở thời điểm tiến triển osimertinib có thể làm sáng tỏ khả năng chuyển dạng. Quan trọng hơn, sự chuyển dạng tế bào nhỏ được cho là cơ chế kháng tiên phát osimertinib. Gần đây còn thấy sự chuyển dạng tế bào vảy sau thất bại osimertinib bước 1, bước sau.
Liên quan tới yếu tố chuyển dạng biểu mô thành trung mô (EMT), tế bào kháng mắc phải gefitinib, osimertinib có đặc điểm EMT với giảm protein gắn biểu mô như E-cadherin và tăng marker trung mô như vimentin mà không có đột biến EGFR thứ hai nào khác.
Đặc điểm EMT của tế bào kháng osimertinib liên quan tới sự tăng điều hòa Zeb1, và sự đảo ngược EMT bởi thuốc ức chế dual histone deacetylase HDAC, hydroxy-3-methylglutaryl co-enzyme A reductase (HMGR) phục hồi sự nhạy cảm osimertinib invitro. Sự kháng osimertinib cũng kết hợp sự quá bộc lộ yếu tố sao chép EMT TWIST-1 ở tế bào đột biến EGFR và chiến lược mới ức chế TWITS-1 đang được nghiên cứu.
3. HƯỚNG ĐIỀU TRỊ SAU KHÁNG OSIMERTINIB
Sự mất T790M khi điều trị osimertinib có thể làm xuất hiện lại các đột biến EGFR ban đầu và có thể điều trị lại với thuốc đích thế hệ 1, nhưng mất T790M thường kèm các cơ chế kháng mới như khuếch đại MET, đột biến KRAS dẫn tới không hiệu quả với thuốc thế hệ 1.
Đột biến C797S là đột biến thứ 3 hay gặp nhất kháng osimertinib nên được tập trung nghiên cứu, các thuốc EGFR thế hệ 4 được phát triển nhắm đích C797S, trong số đó EAI045 là thuốc ức chế allen không gian cho hiệu quả với bộ 3 đột biến C797S-T790M-L858R khi kết hợp cetuximab, nhưng kém hiệu quả với bộ 3 C797S-T790M-exon19del do sự khác biệt cấu trúc và không gian. JBL-04-125-02 là thuốc ức chế allen EGFR mới có thể ức chế tín hiệu EGFR C797S-T790M-L858R invitro và invivo và kết hợp với osimertinib hiệu quả hơn đơn trị.
Brigatinib ức chế ALK-EGFR có hiệu quả với C797S-T790M-exon19del invitro và invivo. Nghiên cứu khác kết hợp brigatinib+osimertinib+bevacizumab có thể điều trị hiệu quả ung thư biểu mô tuyến có bộ 3 L858R-T790M-cisC797S. Với đột biến ít gặp như: L718Q, L844V các dữ liệu tiền lâm sàng thấy hiệu quả của afatinib nếu không có T790M. Tương tự, các dữ liệu tiền lâm sàng thấy đột biến thứ phát L718V kháng osimertinib nhưng nhạy cảm với afatinib.
Dữ liệu tiền lâm sàng thấy bổ sung hóa chất có platinum với osimertinib có thể dung nạp ở bệnh nhân đã điều trị thuốc đích. Nghiên cứu pha 1 carboplatin/etoposide + osimertinib có biến đổi đồng thời RB1 và TP53 để phòng sự chuyển dạng tế bào nhỏ đang được tiến hành. Kết hợp crizotinib+osimertinib có hiệu quả với bệnh kháng osimertinib do khuếch đại MET. Các dữ liện tiền lâm sàng thấy ức chế MEK selumetinib+osimertinib có hiệu quả phòng kháng osimertinib.
Kết hợp osimertinib+trastuzumab-emtansine có thể vượt qua sự kháng osimertinib ở dòng tế bào tăng khuếch đại HER2. Osimertinib kết hợp thuốc ức chế con đường khác như BRAF, AXL cabozantinib có thể vượt qua kháng osimertinib. Nghiên cứ TATTON đánh giá kết hợp osimertinib và savolitinib (ức chế c-MET) hoặc selumetinib (ức chế MEK1/2) sau tiến triển thuốc đích.
Kết hợp osimertinib với thuốc ức chế miễn dịch durvalumab thể hiện hiệu quả hứa hẹn ở cả bệnh nhân đã điều trị đích hoặc chưa điều trị nhưng nhiều độc tính phổi. Về hiệu quả của aspirin giảm AKT phosphoryl hóa, nghiên cứu kết hợp osimertinib+aspirin đanh được đánh giá. Các nghiên cứu khác kết hợp osimertinib với bevacizumab, ức chế Bcl-2 navitoclax, ức chế mTor1/2 sapanisertinib. Kết hợp osimertinib với thuốc ức chế CD4/6 đang nghiên cứu.
3.1. Nhắm đích C797S
Các thuốc đích thế hệ 4 đang được thử nghiệm gồm: EAI045, JBL-04-125-02, BLU-945, BBT-176, BDTX-1535. EAI045 là thuốc ức chế sự thay đổi enzyme có hiệu quả ức chế invitro, invivo đột biến C797S, tuy nhiên EAI045 không hiệu quả nếu dùng đơn trị mà cần kết hợp cetuximab. JBL-04-125-02 là thuốc ức chế thay đổi enzyme mạnh hơn nhắm đích L858R và ức chế L858R/T790M/C797S invitro và invivo. Kết hợp với osimertinib tăng sự chết chương trình và làm chậm kháng thuốc, tuy nhiên hạn chế của thuốc là không ức chế được exon19del.
BLU-945 là dạng thuốc ức chế đột biến T790M và C797S khi kết hợp với thuốc khác. BLU-945 thể hiện hoạt tính kháng u invitro và invivo khi dùng đơn độc và có thể vượt qua kháng thuốc nếu kèm osimertinib. Các dữ liệu thấy BLU-945 ức chế bộ 3 exon19del/T790M/C797S. BLU-945 hiện đang được thử nghiệm pha 1/2 dùng đơn độc hoặc kèm osimertinib trong thử nghiệm SYMPHONY.
BLU-701 cũng là dạng thuốc ức chế thuận nghịch EGFR với khả năng ức chế bộ đôi đột biến exon19del/C797S hoặc L859R/C797S. BLU-701 thể hiện hoạt tính kháng EGFR đột biến mạnh trong khi bảo tồn EGFRwt và có khả năng ngấm tốt sọ não invivo. BLU-701 hiện được đánh giá trong thử nghiệm HARMONY. BBT-176 có thể ức chế exon19del/T790M/C797S và L858R/T790M/C797S. JIN-A02 là thuốc uống kháng EGFR thế hệ 4 nhắm đích C797S thể hiện khả năng ức chế bộ đôi hoặc bộ 3 đột biến EGFR: ex19del/T790M hoặc ex19del/T790M/C797S. Hoạt tính kháng u còn mở rộng với đột biến EGFR khác như L718Q.
3.2. Nhắm đích khuếch đại MET
Khuếch đại MET gặp khoảng 10-25% sau kháng thuốc đích EGFR và có thể vượt qua khi kết hợp thuốc kháng MET. Gần đây kết quả pha 1 kết hợp savolitinib+osimertinib trong thử nghiệm TATTON cho thấy có thể là lựa chọn điều trị. Thử nghiệm đang tiến hành gồm SAVANNAH kết hợp osimertinib+savolitinib ở bệnh nhân kháng osimertinib qua MET và thử nghiệm pha 3 SAFRON so sánh osimertinib+savolitinib với hóa chất ở cùng nhóm bệnh nhân. Các thuốc kháng MET khác cũng báo cáo có hiệu quả như crizotinib, capmatinib.
Ngoài thuốc ức chế MET thì thuốc ADC và kháng thể đang được phát triển. Trong thử nghiệm REGN5093, thuốc Telisituzumab Vedotin (Teliso-V) là thuốc ADC kháng MET đã thể hiện hoạt tính kháng u với sự quá bộc lộ protein c-MET. Ở nhóm EGFRwt/MET tỉ lệ đáp ứng 36.1% với thời gian đáp ứng trung bình 6.9 tháng, nhưng ở nhóm EGFR đột biến/MET thì đáp ứng chỉ 25.8%. Tháng 1/2022, FDA chấp thuận Teliso-V cho ung thư phổi có bộc lộ cao MET.
3.3. Nhắm đích trộn lẫn gen
Với các trộn lẫn gen mắc phải gồm ALK, RET, BRAF thì liệu pháp nhắm đích EGFR và gen trộn lẫn có thể cân nhắc. Các tái sắp xếp gen hay gặp gồm: RET 43%, ALK 26%, NTRK1 16% và FGFR3 11%.
Kết hợp điều trị cho thấy đáp ứng lâm sàng sớm với osimertinib+alectinib, osimertinib+pralsetinib. Nghiên cứu ORCHARD sau osimertinib đang tiến hành để đánh giá khi nào nhắm đích kết hợp EGFR và ALK, RET có hiệu quả.
3.4. Kết hợp kháng thể đôi dòng amivantamab
Amivantamab là kháng thể 2 dòng kháng EGFR, MET, amivantamab được chấp thuận điều trị EGFR exon20ins sau tiến triển hóa chất platinum.
Thử nghiệm pha 1 CHRYSALIS đánh giá amivantamab đơn độc hoặc kết hợp lazertinib ở giai đoạn tiến triển có nhiều đột biến EGFR. Trong nhóm kháng osimertinib có đột biến ex19del, L858R, tỉ lệ đáp ứng với amivantamab đơn chất và kết hợp là 19% và 36%, thời gian đáp ứng trung bình mDOR là 5.9 tháng và 9.6 tháng, mPFS là 4.2 tháng và 4.6 tháng. Kết quả tốt hơn ở nhóm kết hợp ủng hộ khái niệm nhắm đích 2 vị trí ngoài tế bào và phần bào tương của EGFR. Tỉ lệ đáp ứng cũng tốt ở nhóm kháng thuốc có đột biến MET với đáp ứng 47% so với 29% ở nhóm kháng không phụ thuộc MET. Sự có mặt của cơ chế kháng trung gian MET hoặc quá bộc lộ MET có thể là marker cho đáp ứng với amivantamb/lazertinib.
Thử nghiệm CHRYLASIS 2 đánh giá aminvantamb/lazertinib ở nhóm đột biến EGFR sau osimertinib và hóa chất. Dữ liệu ban đầu thấy đáp ứng 41%, ở nhóm đã điều trị nhiều đợt (4 phác đồ) đáp ứng là 21%. Kết quả đáp ứng tương tự với nhóm sau osimertinib nhưng chưa dùng hóa chất gợi ý hóa chất không ảnh hưởng tới hiệu quả của amivantamb/lazertinib.
3.5. Thuốc kháng thể liên hợp ADC
Patritumab deruxtecan là thuốc ADC nhắm đích HER3 mới gồm kháng thể đơn dòng IgG1 nhắm HER3 gắn deruxtecan là thuốc ức chế topoimerase I. HER3 quá bộc lộ trong 42-83% UTPKTBN và có tiên lượng xấu. Trong nghiên cứu pha I ở bệnh nhân đột biến EGFR thất bại osimertinib và hóa chất được dùng patritumab-deruxtecan liều 5.6mg/kg IV mỗi 3 tuần cho đáp ứng 39%, mDOR và mPFS đạt 7 tháng và 8.2 tháng. Tác dụng của thuốc mạnh ở nhóm đã điều trị đến 4 line điều trị trước đây, quan trọng hơn là tác động lên nhiều cơ chế kháng osimertinib.
Datopotamab deruxtecan (Dato-DXd) là thuốc ADC gồm kháng thể đơn dòng chống TROP2 và phần deruxtecan. TROP2 quá bộc lộ trong UTPKTBN không phụ thuộc đột biến gen và có tiên lượng xấu. Dữ liệu ban đầu từ thử nghiệm pha I TROPION-PanTumor01 ở bệnh nhân đã điều trị nhiều đợt và có đột biến EGFR cho đáp ứng 35% và mDOR đạt 9.5 tháng.
3.6. Chuyển dạng tế bào nhỏ, tế bào vảy
Sự chuyển dạng tế bào là cơ chế kháng với các thế hệ thuốc. Chuyển dạng tế bào nhỏ gặp ở 3-10% sau tiến triển thuốc đích thế hệ 1 và 15% sau tiến triển osimertinib.
Sự đột biến đồng thời TP53/Rb1 trong ung thư biểu mô tuyến có nguy cơ cao hơn 43 lần với sự chuyển dạng tế bào. Hiện nay chưa có khuyến cáo điều trị cho dạng đột biến đồng thời này mà chỉ có thể theo dõi sát và sinh thiết lại tìm sự chuyển dạng ở thời điểm tiến triển. Nếu chuyển dạng tế bào nhỏ thì hóa trị cisplatin/etoposid là điều trị ưu tiến, vai trò của thuốc miễn dịch chưa rõ ràng. Quan trọng hơn là xuất hiện lại dòng tế bào ung thư phổi không tế bào nhỏ sau chuyển dạng ở một số ca, do đó cần sinh thiết lại nếu có thể khi bệnh tiến triển sau hóa trị cisplatin/etoposid.
TÀI LIỆU THAM KHẢO
- Lee J, Piotrowska Z, Soo R, Cho BC, Lim SM. Combatting acquired resistance to osimertinib in EGFR-mutant lung cancer. Ther Adv Med Oncol. 2022 Dec 17;14:17588359221144099. doi: 10.1177/17588359221144099. PMID: 36544540; PMCID: PMC9761802.
- Leonetti, A., Sharma, S., Minari, R. et al. Resistance mechanisms to osimertinib in EGFR-mutated non-small cell lung cancer. Br J Cancer 121, 725–737 (2019). https://doi.org/10.1038/s41416-019-0573-8
Để biết thêm chi tiết xin liên hệ:
- Ths.Bs. Trần Khôi.
- Bệnh viện Phổi Hà Nội
- 44 Thanh Nhàn, Hai Bà Trưng, Hà Nội
- Hotline: 0983 812 084, 0913 058 294
- CHỮA BỆNH UNG THƯ PHỔI: https://www.facebook.com/groups/894940984347355
- YouTube: https://www.youtube.com/channel/UCjueL8VycYzFjGkVcglHV2g (comment các vấn đề thắc mắc)




