KẾT HỢP MIỄN DỊCH PEMBROLIZUMAB VÀ HÓA CHẤT Ở NHÓM PDL1 ÂM TÍNH
10:08 - 26/09/2023
Hiệu quả của kết hợp thuốc miễn dịch pembrolizumab và hóa trị so sánh với hóa trị đơn thuần ở bệnh nhân Châu Á có PDL1 âm tính và giai đoạn bệnh tiến triển, di căn.
Khối u giảm càng nhiều, sống càng lâu: Giá trị tiên lượng trong điều trị ung thư phổi đột biến EGFR
Giảm khối u càng sâu, sống càng lâu: Đột phá trong điều trị ung thư phổi EGFR bằng thuốc nhắm trúng đích
Thuốc đích EGFR trong điều trị ung thư phổi giai đoạn 4: Thời gian lui bệnh và ý nghĩa lâm sàng
Hiệu quả thuốc đích Osimertinib trong điều trị di căn gan ung thư phổi đột biến EGFR+ giai đoạn 4
MIỄN DỊCH PEMBROLIZUMAB KẾT HỢP HÓA TRỊ VỚI KHỐI U PDL1 ÂM TÍNH Ở BỆNH NHÂN CHÂU Á
1. Giới thiệu
Ung thư phổi vẫn là nguyên nhân tử vong hàng đầu trên thế giới, phần lớn bệnh nhân được chẩn đoán ở giai đoạn di căn dẫn tới tiên lượng xấu và tỉ lệ sống thêm 2 năm, 5 năm thấp.
Thuốc miễn dịch kháng PD1 Pembrolizumab có hiệu quả cải thiện sống còn ở bệnh nhân ung thư phổi tiến triển di căn chưa điều trị trước đây; pembrolizumab có thể dùng đơn trị hoặc kết hợp hóa chất bất kể mức độ bộc lộ PDL1 của khối u.
Đặc biệt ở bệnh nhân Châu Á đã có nhóm G của nghiên cứu KEYNOTE-021, KEYNOTE-189 và nhánh của KEYNOTE-407 thu nhận bệnh nhân Nhật Bản và Trung Quốc đều cho thấy hiệu quả của pembrolizumab kết hợp hóa chất.
Pembrolizumab kết hợp hóa chất là điều trị tiêu chuẩn với ung thư phổi không tế bào nhỏ (UTPKTBN) bất kể PDL1 âm hay dương tính. 1/3 đến 1/2 bệnh nhân Đông Á ở giai đoạn di căn không bộc lộ PDL1 và đại diện cho một lượng lớn bệnh nhân có thể điều trị kết hợp pembrolizumab và hóa trị.
Một phân tích tổng hợp gần đây từ các KEYNOTE cho thấy pembrolizumab kết hợp hóa chất giúp cải thiện sống thêm toàn bộ OS và sống thêm không tiến triển PFS so với hóa trị đơn thuần với chỉ số HR lần lượt là 0,63 và 0,68; tỉ lệ đáp ứng ORR cũng cao hơn là 50% so với 29,8%.
Nghiên cứu này thiết kế cho bệnh nhân có PDL1 âm tính được kết hợp điều trị miễn dịch pembrolizumab và hóa trị so sánh với hóa trị đơn thuần với cỡ mẫu hơn 100 bệnh nhân Nhật Bản và Trung Quốc.
2. Đặc điểm nghiên cứu
Dữ liệu bệnh nhân được thu thập từ các nghiên cứu. Bệnh nhân trên 18 tuổi, giai đoạn bệnh tiến triển, chỉ số ECOG 0-1, đánh giá đáp ứng theo RECIST 1.1. Loại trừ các bệnh nhân đã điều trị toàn thân trước đó, di căn hệ thần kinh có triệu chứng, bệnh lý tự miễn, nhiễm trùng tiến triển, tiền sử viêm phổi cần dùng steroid và có đột biến EGFR, ALK.
Trong các nghiên cứu bệnh nhân được điều trị kết hợp pembrolizumab+carboplatin (cisplatin)/pemetrexed (paclitaxel) x 4 chu kỳ sau đó duy trì kéo dài với pembrolizumab x 31 chu kỳ.
Xét nghiệm bộc lộ PDL1 được thực hiện nhất quán trước điều trị với hóa chất 22C3 pharmDx của Mỹ. Chụp CT ngực khối u vào tuần 6, 12, 18; sau đó cứ 9 tuần chụp một lần cho đến tuần thứ 45, 48 hoặc 52; và sau đó là mỗi 12 tuần. Đánh giá đáp ứng u theo RECIST 1.1.
Tỷ lệ sống sót được đánh giá mỗi 8 hoặc 12 tuần một lần, các tác dụng phụ phân loại theo tiêu chuẩn CTAE 4.0.
Tỷ lệ đáp ứng ORR và PFS, OS trong đa số nghiên cứu, ngoài ra có thời gian đáp ứng trung bình DOR là tiêu chí phụ, PFS2 là thời gian từ khi điều trị bước 2 đến khi bệnh tiến triển tiếp theo (gồm cả nhóm chuyển chéo sang dùng pembrolizumab).
2. Kết quả nghiên cứu
a. Đặc điểm tổng quát bệnh nhân
Tổng cộng có 107 bệnh nhân PDL1 âm tính vào nghiên cứu trong đó 56 bệnh nhân điều trị miễn dịch+hóa chất và 51 bệnh nhân chỉ dùng hóa chất đơn thuần, tỉ lệ nam giới đa số chiếm 87,9% và ECOG 1 chiếm 66,4%.
Tuổi trung bình là 65. Thời gian trung bình từ khi chọn ngẫu nhiên đến khi kết thúc theo dõi là 33,4 tháng. 9 bệnh nhân ở nhóm hóa miễn dịch và 1 bệnh nhân nhóm hóa trị hoàn thành đầy đủ phác đồ và 1 bệnh nhân ở mỗi nhóm vẫn đang điều trị khi kết thúc theo dõi.
Nguyên nhân chủ yếu phải dừng điều trị là: 1) tử vong (57% hóa miễn dịch và 73% hóa trị) và 2) độc tính (5% và 4%). 18 bệnh nhân hóa trị (35%) đã chuyển sang dùng pembrolizumab đơn trị. Thời gian điều trị trung bình ở hóa miễn dịch là 9,8 tháng và hóa trị là 5,8 tháng.
b. Kết quả điều trị
Tổng cộng có 76/107 (71%) bệnh nhân đã tử vong khi kết thúc theo dõi, OS trung bình là 21,3 tháng ở nhóm hóa miễn dịch và 12,6 tháng hóa trị đơn thuần.
Tỷ lệ sống thêm 1 năm và 2 năm lần lượt là 79% và 46% ở nhóm hóa miễn dịch và 52% và 28% ở nhóm hóa trị. Chỉ số HR với OS cho nhóm hóa miễn dịch với ECOG 0, không có tiền sử hút thuốc, và dùng nab-paclitaxel, nhưng chú ý số lượng bệnh nhân là hạn chế.
Khi kết thúc theo dõi, 94/107 (88%) bệnh nhân đã tiến triển hoặc tử vong. PFS trung bình với hóa miễn dịch là 8,4 tháng và 6 tháng với hóa trị. PFS 1 và 2 năm lần lượt là 33% và 17% với hóa miễn dịch; 16% và 10% ở nhóm hóa trị đơn thuần.
Tỷ lệ đáp ứng là 71% ở nhóm hóa miễn dịch và 43% ở nhóm hóa trị đơn thuần. Gồm 1 đáp ứng hoàn toàn và 39 đáp ứng một phần ở nhóm hóa miễn dịch; 22 đáp ứng một phần với hóa trị.
DOR trung bình là 6,7 tháng ở nhóm hóa miễn dịch và 4,9 tháng ở nhóm hóa trị. PFS2 trung bình là 15,8 tháng ở nhóm hóa miễn dịch và 9 tháng với hóa trị đơn thuần.
Với bệnh nhân chuyển từ hóa trị sang pembrolizumab có 18 bệnh nhân, OS trung bình từ khi bắt đầu dùng pembrolizumab là 11,7 tháng (6-18,9 tháng) và PFS trung bình là 2,8 tháng, PFS 6 tháng là 17%.
Với bệnh nhân hoàn thành 35 chu kỳ miễn dịch có 9 bệnh nhân (16%), tất cả đều còn sống ở thời điểm kết thúc theo dõi. Tỷ lệ PFS 1 và 2 năm đều là 89%, tất cả đều đạt đáp ứng một phần với DOR trung bình là 31,1 tháng.
Các tác dụng phụ gặp ở 98% nhóm hóa miễn dịch và 100% nhóm hóa trị gồm: rụng tóc (54% vs 45%), giảm bạch cầu (52% vs 51%), thiếu máu (50% vs 63%), giảm thèm ăn (43% vs 47%), buồn nôn (30% vs 25%). Các độc tính đồ 3-5 gặp ở 71% nhóm hóa miễn dịch và 76% hóa trị. 2 bệnh nhân nhóm hóa miễn dịch tử vong vì độc tính trong khi nhóm hóa trị là 0 bệnh nhân.
Tác dụng phụ phản vệ tiêm truyền gặp ở 39% hóa miễn dịch và 8% hóa trị. Độc tính qua trung gian miễn dịch chủ yếu là cường giáp (11% vs 0%), suy giáp (9% vs 0%), viêm phổi (7% vs 8%), độc tính độ 3-5 gặp ở 11% nhóm hóa miễn dịch và 4% nhóm hóa trị.
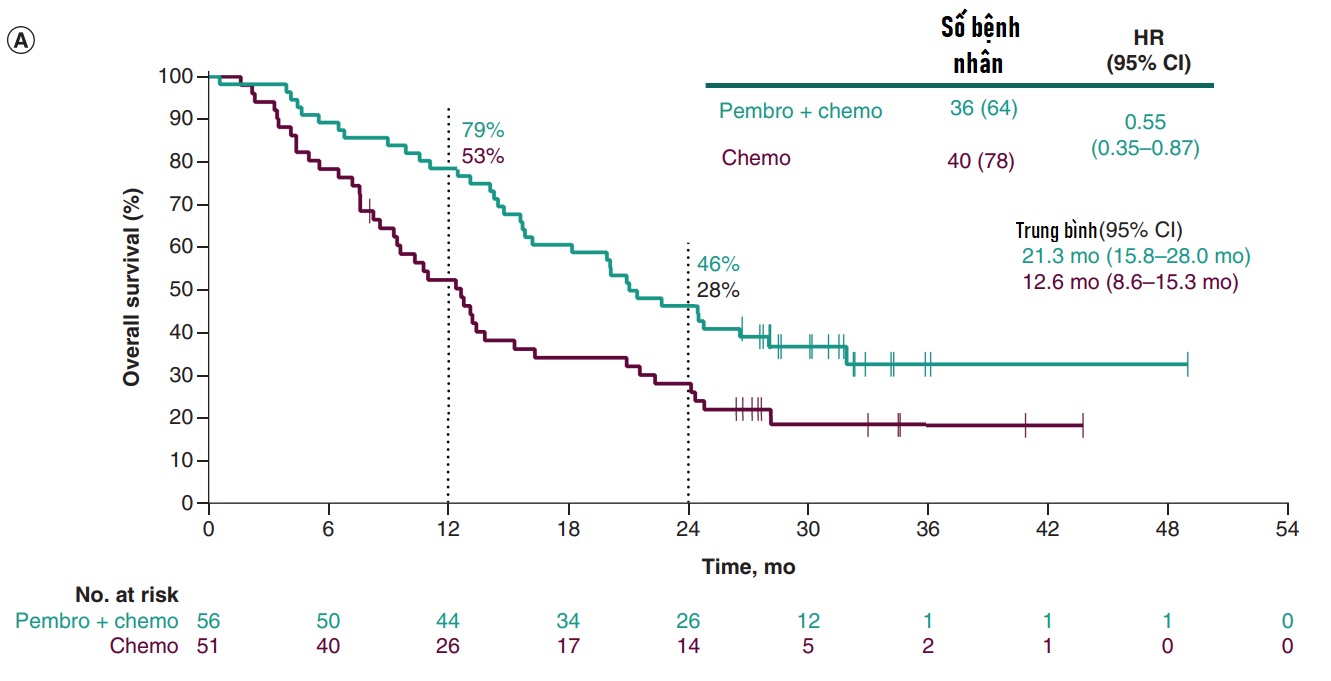
Thời gian sống thêm trung bình hóa miễn dịch 21,3 tháng; hóa trị 12,6 tháng; HR 0,55
3. Thảo luận
Kết quả nghiên cứu này đại diện cho một nhóm bệnh nhân có thể điều trị kết hợp hóa chất và miễn dịch pembrolizumab kể cả khi PDL1 âm tính. Kết quả cho thấy lợi ích sống thêm kéo dài khi kết hợp hóa chất và miễn dịch.
Tỷ lệ sống thêm 2 năm là 46% với hóa miễn dịch so với 28% hóa trị, HR về OS tốt hơn với pembrolizumab so với hóa trị đạt 0,55. Lợi ích về OS song song với cải thiện đáp ứng ORR và DOR khi có pembrolizumab. Tỷ lệ kiểm soát bệnh cao 95% nhóm hóa miễn dịch so với 78% hóa trị.
Hóa miễn dịch giúp cải thiện PFS sớm với sự tách sớm 2 đường cong và điều này giúp dự báo lợi ích lâu dài của miễn dịch. Kết quả nà phù hợp với phân tích toàn cầu về hiệu quả của pembrolizumab cải thiện OS (19 tháng vs 11,4 tháng; HR: 0,63) và PFS (6,9 tháng vs 5,8 tháng; HR: 0,68), ORR cũng cao hơn (50% vs 30%).
Trong số bệnh nhân hóa trị chuyển sang đơn trị pembrolizumab, OS trung bình cao hơn 11,7 tháng và PFS 2,8 tháng. Điều này rất quan trọng vì PDL1 âm tính thường không đủ điều kiện để dùng pembrolizumab đơn trị. Hơn nữa, PFS2 cũng dài hơn ở nhóm hóa miễn dịch nên sự kết hợp này càng được hỗ trợ hiệu quả.
Tất cả bệnh nhân trong nghiên cứu đều gặp phải ít nhất 1 độc tính và các độc tính đều đã có y văn. So với phân tích toàn cầu, các độc tính độ 3-5 đều có tỷ lệ tương đương. Lợi ích ở nhóm PDL1 âm tính đều nhất quán với PDL1 dương tính trong các nghiên cứu KEYNOTE.
TÀI LIỆU THAM KHẢO
Ying Cheng, James Chih-Hsin Yang, Isamu Okamoto, Li Zhang, Jie Hu, Donglin Wang, Chengping Hu, Jianying Zhou, Lin Wu, Lejie Cao, Jiwei Liu, Helong Zhang, Hong Sun, Ziping Wang, Hongjun Gao, Yan Yan, Suijun Xiao, Jianxin Lin, M. Catherine Pietanza, and Takayasu Kurata
Immunotherapy 2023 15:13, 1029-1044




