CẬP NHẬT ĐỘT BIẾN EGFR VÀ CÁC THUỐC ĐIỀU TRỊ
06:40 - 25/02/2023
Cập nhật mới về đột biến EGFR trong ung thư phổi và các vấn đề liên quan điều trị thuốc đích.
Khối u giảm càng nhiều, sống càng lâu: Giá trị tiên lượng trong điều trị ung thư phổi đột biến EGFR
Giảm khối u càng sâu, sống càng lâu: Đột phá trong điều trị ung thư phổi EGFR bằng thuốc nhắm trúng đích
Thuốc đích EGFR trong điều trị ung thư phổi giai đoạn 4: Thời gian lui bệnh và ý nghĩa lâm sàng
Hiệu quả thuốc đích Osimertinib trong điều trị di căn gan ung thư phổi đột biến EGFR+ giai đoạn 4
ĐỘT BIẾN EGFR VÀ ĐIỀU TRỊ TỐI ƯU
- Tổng quan
Việc tìm ra các đột biến gen EGFR giúp dự báo đáp ứng tốt với thuốc đích điều trị tương ứng đã tạo ra cuộc cách mạng mới trong điều trị chính xác ung thư phổi. Phân tích gen khối u hiện là bước quan trọng trong chẩn đoán và điều trị ung thư phổi giai đoạn muộn, cho phép đưa ra phác đồ cụ thể tốt nhất với từng người bệnh. Các thử nghiệm trước đây cho thấy thuốc đích TKIs với đột biến EGFR cho tỉ lệ đáp ứng và thời gian sống không bệnh tiến triển (PFS) tốt hơn nhiều so với hóa chất, nhất là ở nhóm có đột biến EGFR nhạy cảm.
Đột biến EGFR gặp ở 40-60% người Châu Á, nữ giới trẻ tuổi và không hút thuốc, đột biến hay gặp ở thể ung thư phổi biểu mô tuyến với 2 loại đột biến hay gặp nhất là exon19del và L858R, ngoài ra còn một số đột biến EGFR ít gặp như exon19ins, exon20ins, G719X, S768I, L861Q. Đột biến EGFR gặp ở 42.5% người không hút thuốc, 13.5% ít hút thuốc và 4.9% người hút nhiều thuốc. Đột biến EGFR gặp nhiều ở nữ giới chủ yếu do hút thuốc ít và ít gặp ở thể bệnh ung thư phổi tế bào vảy, tế bào nhỏ.
Các thuốc đích ban đầu được chấp thuận điều trị 2 đột biến nhạy thuốc: exon19del và L858R dựa trên hiệu quả vượt trội so với hóa chất có platinum, 2 thuốc thế hệ 1 là erlotinib và gefitinib đều có PFS dài hơn hóa chất khi điều trị bước 1. Các thuốc đích thế hệ 2 afatinib, dacomitinib cũng đều vượt trội so với hóa chất, và dacomitinib ưu thế hơn thuốc đích thế hệ 1 gefitinib ở chỉ số PFS, tuy nhiên độc tính cũng cao hơn. Các thuốc thế hệ 2 này cũng được chấp thuận điều trị bước 1 cho ung thư phổi biểu mô tuyến di căn có đột biến EGFR nhạy thuốc.
Mặc dù khá hiệu quả nhưng sự kháng thuốc đích bởi khối u gây giới hạn hiệu quả của thuốc đích. Một trong những đột biến chính gây kháng thuốc đích thế hệ 1, 2 là đột biến T790M gặp ở 50-70% trường hợp kháng thuốc. Đột biến T790M có thể gặp trước khi điều trị thuốc đích, có vai trò trong sự kháng tiên phát với thuốc đích thế hệ 1, 2.
Thuốc đích thế hệ 3 được ra đời từ đây nhằm khắc phục đột biến kháng thuốc này. Osimertinib là thuốc điều trị T790M hiệu quả ở nhóm kháng thuốc với đáp ứng 70%. Khi so sánh với thuốc đích thế hệ 1 trong điều trị bước 1, osimertinib cũng kéo dài hơn đáng kể chỉ số PFS và thời gian sống thêm (OS), hơn nữa osimertinib có khả năng ngấm tốt vào hệ thần kinh để kiểm soát các di căn sọ não.
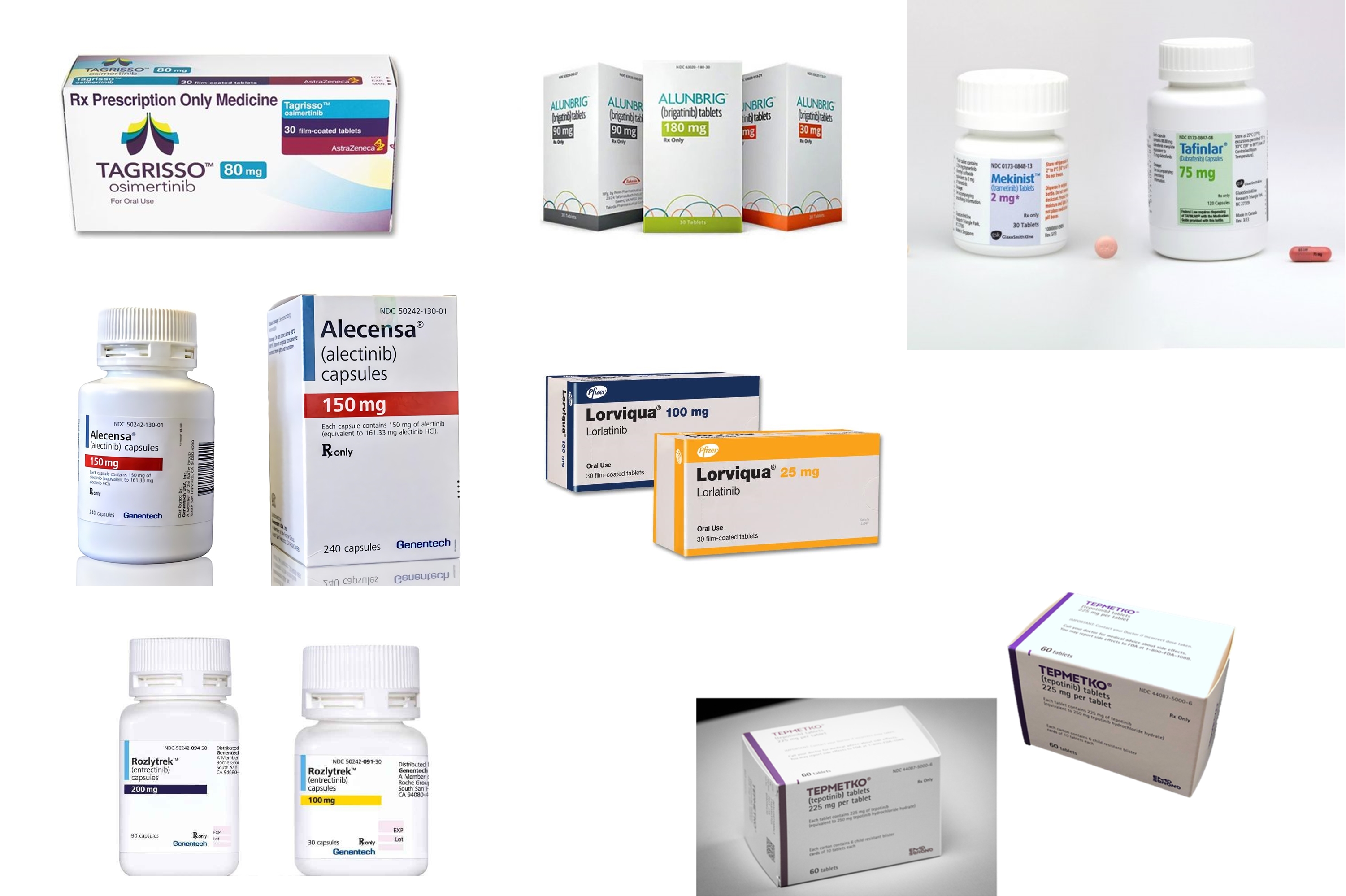
- Thuốc đích điều trị đột biến EGFR
Phần lớn đột biến EGFR ảnh hưởng tới phần nội bào tyrosine kinase của receptor gồm nhóm các đột biến từ exon 18-21, là đột biến dẫn đường sinh ung thư chia thành 2 nhóm đột biến nhạy thuốc và đột biến ít gặp.
Các đột biến nhạy thuốc chiếm 85% gồm exon19del (45%) và L858R (40%) nhạy cảm với 3 thế hệ thuốc đích. Các đột biến ít gặp chiếm 10-15% gồm một nhóm các đột biến ở exon18 (E709X, G719X), exon19 (exon19ins), exon20 (exon20ins, S768I) và exon21 (L861Q). Quan trọng hơn là các đột biến có thể xảy ra đồng thời ở 15% ung thư phổi biểu mô tuyến có đột biến EGFR.
Đột biến kháng thuốc T790M hay gặp nhất xảy ra ở exon20, đột biến gặp ở 50-70% khi kháng thuốc thế hệ 1, 2. Đột biến này gây kháng hoàn toàn với thuốc thế hệ 1, thuốc đích thế hệ 2 với nồng độ cao có thể ức chế được T790M nhưng độc tính lại quá nặng. Do đó khuyến cáo điều trị hiện nay với đột biến T790M là thuốc đích thế hệ 3 osimertinib.
2.1. Thuốc đích điều trị ung thư phổi biểu mô tuyến có đột biến EGFR nhạy thuốc
Qua nhiều năm sử dụng, thuốc đích cho thấy hiệu quả kiểm soát bệnh và an toàn kể cả ở bệnh nhân lớn tuổi, tỉ lệ đáp ứng khoảng 60%-75% với thời gian PFS khoảng 11 tháng. Hiệu quả vượt trội so với hóa chất thể hiện qua nhiều thử nghiệm lâm sàng, cải thiện đáng kể chất lượng cuộc sống và dễ dàng quản lý việc sử dụng thuốc.
Độc tính chính của thuốc đích gặp trên đường tiêu hóa và trên da. Độc tính da gồm: mụn mủ dạng trứng cá, viêm nang lông, khô da, viêm quanh móng, viêm niêm mạc, viêm miệng. Một số nghiên cứu cho thấy mối liên hệ giữa độc tính da và hiệu quả cao hơn của thuốc. Các độc tính khác ít gặp hơn gồm: giảm ngon miệng, độc tính huyết học, đau cơ, mệt mỏi, ho. Osimertinib thể hiện ít độc tính hơn thuốc đích thế hệ 1, 2.
2.2. Hiệu quả của thuốc đích với các đột biến EGFR ít gặp
Hiệu quả của thuốc đích với các đột biến ít gặp còn chưa thống nhất, đáng chú ý là các đột biến này có thể đồng thời với đột biến nhạy thuốc exon19del, L858R và có thể nhạy cảm hơn và thuyên giảm bệnh lâu hơn khi điều trị thuốc đích.
Đột biến G719X ở exon18 gặp khoảng 1.5-3% đột biến EGFR. Nghiên cứu thấy erlotinib, gefitinib cho đáp ứng khoảng 36.8% với PFS 6.3 tháng. Afatinib cũng hiệu quả với G719X, osimertinib cho đáp ứng 52.6%. Đột biến đồng thời exon19del hoặc L858R với G719X cho đáp ứng cao hơn và PFS dài hơn so với G719X đơn thuần. Đột biến exon19ins chiếm khoảng 1% đột biến EGFR và thuốc đích thế hệ 1 cho đáp ứng tốt khoảng 40%.
Với đột biến ở exon20, ngoài T790M còn một số đột biến cài ins khác chiếm 10%. Hiệu quả của thuốc thế hệ 1 với exon20ins khá thấp với đáp ứng 8-27% và PFS 2-2.5 tháng và hóa chất là điều trị tiêu chuẩn ở trường hợp này. Tương tự như vậy với thuốc thế hệ 2 afatinib và dacomitinib. Thuốc thế hệ 3 có hiệu quả hơn một chút với đáp ứng khoảng 25% và PFS 9.7 tháng.
S768I là đột biến exon20 ít gặp khác chiếm khoảng 0.5%, trong số các thuốc đích thì afatinib thể hiện hiệu quả tốt nhất với đáp ứng 100% và PFS 14.7 tháng (chú ý nghiên cứu với số lượng bệnh nhân ít). Đột biến L861Q ở exon21 với tỉ lệ gặp 3% nhạy cảm với afatinib và osimertinib (đáp ứng 56.3% và 77.8%).
2.3. Điều trị di căn não có đột biến EGFR
Tỉ lệ có di căn não cao hơn nếu có đột biến EGFR so với không đột biến (31% và 19.7%). Di căn não gây giảm chất lượng cuộc sống và rút ngắn thời gian sống thêm. Thuốc thế hệ 3 osimertinib đã thể hiện hiệu quả với di căn não hơn thế hệ 1. Tỉ lệ kiểm soát bệnh di căn não cao tới 91% và tỉ lệ bệnh tiến triển nặng nội sọ cũng thấp hơn với osimertinib. Thời gian PFS di căn não của osimertinib dài hơn hóa chất (11.7 vs 5.6 tháng).
- Cơ chế kháng thuốc đích
Sự kháng thuốc đích do cơ chế tiên phát hoặc mắc phải. Kháng tiên phát do chèn base vào exon20, kháng mắc phải thường do các đột biến mới làm giảm khả năng liên kết hoặc ức chế của thuốc đích. Ngoài ra sự thay đổi kiểu hình tế bào giảm phụ thuộc EGFR như sự tăng điều hòa tín hiệu vượt qua tyrosine kinase, chuyển dạng tế bào nhỏ hoặc chuyển dạng biểu mô sang trung mô cũng gây kháng thuốc.
Đột biến T790M gây kháng thuốc thế hệ 1, 2 ở phần lớn bệnh nhân và đã có thuốc đích thế hệ 3 osimertinib điều trị trường hợp này. Các đột biến mới trong khi điều trị osimertinib gây ra bệnh tiến triển gặp ở 6-10% nếu điều trị bước 1 và 10-26% nếu điều trị bước 2. Trong đó đột biến C797S nổi lên với 14% tỉ lệ xuất hiện gây kháng osimertinib.
Sự xuất hiện các con đường tín hiệu không phụ thuộc EGFR là cơ chế khác gây kháng thuốc, trong đó khuếch đại gen MET là cơ chế hay gặp nhất gây kháng các thế hệ thuốc đích. Tương tự, khuếch đại HER2 có thể là cơ chế sinh ung thư mới khi điều trị đích, khuếch đại HER2 hay gặp với thế hệ thuốc đầu hơn osimertinib.
Các con đường tín hiệu khác gây kháng có thể là sự trộn lẫn gen RET, ALK, đột biến mới trong tín hiệu EGFR như PI3KCA, BRAF V600E cũng gây kháng thuốc. Các dữ liệu cho thấy sự quá bộc lộ yếu tố phát triển nội mạc VEGF cũng gây kháng thuốc điều trị đột biến EGFR. Sự chuyển dạng tế bào nhỏ là cơ chế khác gây kháng thuốc đích, cơ chế này chiếm khoảng 15% sự kháng thuốc và điều trị dựa trên hóa chất cisplatin/etoposid.
- Các hướng điều trị mới với đột biến EGFR
Cần thiết phải có phác đồ mới để vượt qua sự kháng thuốc đích, hiện nay nhiều hướng nghiên cứu mới được thử nghiệm gồm bổ sung hóa chất, kháng thể đơn dòng VEGF/VEGFR2, thuốc miễn dịch.
4.1. Kết hợp hóa chất và thuốc đích
Một số dữ liệu tiền lâm sàng ủng hộ việc kết hợp hóa chất và thuốc đích điều trị đột biến EGFR. Kết hợp pemetrexed giúp làm chậm sự kháng gefitinib ở dòng tế bào có đột biến exon19del. Một thử nghiệm pha II so sánh pemetrexed+gefitinib với gefitinib đơn thuần cho thấy kết hợp điều trị kéo dài hơn PFS nhưng đáp ứng và sống còn OS là tương đương trong khi điều trị kết hợp nhiều độc tính hơn.
Đáng chú ý, kết hợp pemetrexed/carboplatin+gefitinib so với gefitinib đơn thuần cải thiện đáng kể đáp ứng và sống còn OS qua 2 thử nghiệm pha 3. Tuy nhiên các kết quả này bị ảnh hưởng bởi vai trò của osimertinib điều trị bước 1 là điều trị chuẩn và thiếu dữ liệu về sự kết hợp osimertinib với hóa chất. Thử nghiệm FLAURA2 đang tiến hành đánh giá hiệu quả kết hợp pemetrexed/carboplatin+osimertinib ở nhóm biểu mô tuyến có đột biến EGFR.
4.2. Kết hợp kháng thể đơn dòng trực tiếp VEGF/VEGFR2 với thuốc đích
Dữ liệu tiền lâm sàng cho thấy ức chế yếu tố phát triển nội mạc VEGF ức chế được dòng tế bào biểu mô tuyến đột biến EGFR, điều này gợi ý sự nhắm đích 2 con đường EGFR, VEGF có thể có lợi ích lâm sàng.
Thử nghiệm pha II JO25567 cho thấy cải thiện PFS khi kết hợp bevacizumab+erlotinib so với erlotinib đơn thuần (16 vs 9.7 tháng). Ngược lại, thử nghiệm pha II khác lại không cho thấy cải thiện PFS ở nhóm kết hợp. Thử nghiệm pha III cho thấy cải thiện PFS khi kết hợp bevacizumab+erlotinib (16.9 vs 13.3 tháng) so với erlotinib đơn thuần nhưng sống còn lại không cải thiện. Một thử nghiệm pha II gần đây cũng thất bại để chứng minh cải thiện PFS khi kết hợp bevacizumab+osimertinib.
Tiếp cận khác với con đường VEGF, trong nghiên cứu RELAY là thử nghiệm pha III so sánh kết hợp kháng thể đơn dòng VEGFR2 ramucirumab+erlotinib với erlotinib đơn thuần, kết quả nhóm kết hợp cải thiện đáng kể PFS so với erlotinib đơn thuần (19.4 vs 12.4 tháng).
4.3. Thuốc miễn dịch và hóa miễn dịch với ung thư phổi biểu mô tuyến có đột biến EGFR
Các nghiên cứu ban đầu cho thấy đáp ứng thấp với thuốc miễn dịch ở nhóm đột biến EGFR đã dùng thuốc đích trước đây. Phân tích đa biến kết luận rằng thuốc miễn dịch nhắm đích PD-1 pembrolizumab, nivolumab và nhắm PD-L1/2 ateolizumab không hiệu quả để điều trị bước 2 nhóm biểu mô tuyến đột biến EGFR đã tiến triển với thuốc đích. Hơn nữa độc tính nặng cũng là cản trở với sự kết hợp này.
Một thử nghiệm pha III quan trọng Impower 150 đánh giá kết hợp atezolizumab+bevacizumab+hóa chất điều trị, thử nghiệm này có cả nhóm đột biến EGFR và cho thấy cải thiện PFS so với nhóm bevacizumab+hóa chất. Khi tiếp tục theo dõi cho thấy hiệu quả của phác đồ kết hợp ở nhóm đột biến EGFR chủ yếu là các đột biến nhạy thuốc và đã tiến triển với thuốc đích trước đây. Tỉ lệ đáp ứng đạt 71% và cải thiện cả PFS và OS. Điều này cho thấy thuốc miễn dịch vẫn có vai trò với nhóm đột biến EGFR và cần nghiên cứu thêm.
4.4. Chiến lược điều trị mới với đột biến exon20ins
Đột biến exon20ins chiếm 3% ung thư phổi và 12% nhóm biểu mô tuyến đột biến EGFR. Hiệu quả thuốc đích với exon20ins khá thấp và hóa chất vẫn là điều trị chuẩn. Chỉ có 1 nghiên cứu với osimertinib liều cao 160mg/ngày cho đáp ứng 25% khi điều trị exon20ins.
Mobocertinib là thuốc đích ức chế EGFR và HER2, trong thử nghiệm pha I/II đánh giá hiệu quả mobocertinib với exon20ins, 1/3 bệnh nhân có di căn não. Tỉ lệ đáp ứng cao 43% với PFS trung bình 7.3 tháng, 1/3 bệnh nhân gặp tiêu chảy độ 3 hoặc nặng hơn, kết quả này đã giúp mobocertinib được FDA chấp thuận điều trị đột biến exon20ins.
Amivantamab là kháng thể đôi dòng chống EGFR và cMET, thuốc ức chế cả 2 tín hiệu EGFR và cMET, đồng thời thúc đẩy gây độc tế bào phụ thuộc kháng thể trong tế bào ác tính. Hoạt tính của amivantamab với exon20ins thể hiện trong nghiên cứu pha I cho đáp ứng 36%, PFS trung bình 8.6 tháng với chỉ 6% bệnh nhân gặp độc tính nặng >độ 3 và đã được FDA chấp thuận điều trị.
Poziotinib là thuốc đích mới ức chế EGFR, ERBB2, ERBB4. Trong thử nghiệm pha 2 ZENITH-20-1, 115 bệnh nhân exon20ins đã điều trị ít nhất 1 phác đồ được dùng 16mg poziotinib hằng ngày để đánh giá hiệu quả và an toàn. Tỉ lệ đáp ứng 19.3%, PFS 4.2 tháng nhưng >50% bệnh nhân gặp độc tính nặng từ độ 3 trở lên, các độc tính này gây dừng điều trị ở 10% bệnh nhân, gián đoạn điều trị ở 88% và điều chỉnh liều ở 68% bệnh nhân. Do độc tính cao nên thuốc đang được thử nghiệm với liều thấp hơn.
Cuối cùng CLN-081 là thuốc đích mới điều trị exon20ins, trong thử nghiệm pha I/II cho thấy thuốc dung nạp tốt và đáp ứng tốt, đáng chú ý là các bệnh nhân đã dùng trước đây với poziotinib hoặc mobocertinib.

4.5. Thuốc đích mới và kháng thể đơn dòng nhắm đích cơ chế kháng osimertinib
Sự kháng osimertinib vẫn xảy ra dù hiệu quả cao của thuốc. Kết hợp gefitinib+osimertinib được mô tả ở ca bệnh có đột biến T790M và C797S, trong đó có sự thanh thải nhanh dòng C797S mặc dù bệnh tiến triển, gợi ý khối u có đột biến C797S nhạy cảm với thuốc đích thế hệ đầu. Tương tự như vậy với hiệu quả của erlotinib ở bệnh nhân đột biến EGFR điều trị ban đầu với osimertinib và tiến triển do C797S mắc phải.
Với đột biến C797X có thể dùng thuốc đích mới ức chế nhiều vị trí EGFR như EAI045 và JBJ-04-125-02 đang được đánh giá. Với các đột biến trộn gen như ALK, RET có thể kết hợp thuốc nhắm đích các gen trộn này với osimertinib để điều trị.
Tín hiệu MET có thể gây kháng osimertinib và thuốc nhắm đích tín hiệu này có thể hiệu quả. Amivantamab là kháng thể nhắm EGFR và cMET đang được đánh giá thêm. Thử nghiệm TATTON đánh giá hiệu quả và an toàn kết hợp thuốc ức chế cMET savolitinib+osimertinib ở bệnh nhân khuếch đại MET khi tiến triển thuốc đích. Sự kết hợp này cho đáp ứng 64%.
Thử nghiệm quan trọng pha II khác là ORCHARD hiện đang đánh giá hiệu quả, an toàn của một vài phác đồ kết hợp mới dựa trên cơ chế kháng osimertinib như osimertinib+savolitinib với khuếch đại MET, osimertinib+gefitinib (đột biến C797X), osimertinib và kháng thể đơn dòng nhắm EGFR necitumumab (khuếch đại EGFR).
Gần đây phát hiện sự quá bộc lộ receptor protein kinase AXL ở màng tế bào gây kháng thuốc đích và có tiên lượng xấu, thuốc ức chế AXL đang được đánh giá điều trị đơn thuần hoặc kết hợp thuốc đích.
- Kết luận
Sự khám phá ra các thế hệ thuốc đích đã cải thiện đáng kể hiệu quả điều trị ung thư phổi biểu mô tuyến đột biến EGFR. Các đột biến hay gặp nhất là exon19del và L858R nhạy cảm với tất cả các thế hệ thuốc đích. Từ nghiên cứu FLAURA và sự xuất hiện đột biến T790M trong khi điều trị các thế hệ thuốc đích đầu, osimertinib hiện là điều trị chuẩn bước đầu tiên và phát triển nhiều thuốc đích mới có thể ức chế các đột biến kháng thuốc.
TÀI LIỆU THAM KHẢO
- Khaddour K, Jonna S, Deneka A, Patel JD, Abazeed ME, Golemis E, Borghaei H, Boumber Y. Targeting the Epidermal Growth Factor Receptor in EGFR-Mutated Lung Cancer: Current and Emerging Therapies. Cancers (Basel). 2021 Jun 24;13(13):3164. doi: 10.3390/cancers13133164. PMID: 34202748; PMCID: PMC8267708.
Để biết thêm chi tiết xin liên hệ:
- Ths.Bs. Trần Khôi.
- Bệnh viện Phổi Hà Nội
- 44 Thanh Nhàn, Hai Bà Trưng, Hà Nội
- Hotline: 0983 812 084, 0913 058 294
- CHỮA BỆNH UNG THƯ PHỔI: https://www.facebook.com/groups/894940984347355
- YouTube: https://www.youtube.com/channel/UCjueL8VycYzFjGkVcglHV2g (comment các vấn đề thắc mắc)




