Telisotuzumab Vedotin trong điều trị ung thư phổi biểu hiện protein MET cao: Cơ chế, hiệu quả và triển vọng lâm sàng
10:45 - 29/05/2025
Khám phá cơ chế, hiệu quả lâm sàng và triển vọng điều trị của Telisotuzumab Vedotin (Teliso-V) trong ung thư phổi không tế bào nhỏ (UTPKTBN) biểu hiện protein c-Met cao, với phân tích so sánh cùng docetaxel và các thuốc ADC khác từ thử nghiệm LUMINOSITY.
Tiến bộ mới nhất 2025 trong điều trị ung thư phổi tế bào nhỏ (SCLC)
Hiệu quả của vắc xin CIMAvax trong điều trị ung thư phổi: Hy vọng mới cho bệnh nhân
Vắc xin chữa ung thư phổi: cơ chế, tiềm năng, hiệu quả
Thuốc đích mới Divarasib trong ung thư phổi KRAS G12C, hiệu quả dài hạn, an toàn và triển vọng phối hợp
Telisotuzumab Vedotin trong điều trị ung thư phổi không tế bào nhỏ (UTPKTBN) biểu hiện quá mức protein MET
1. Giới thiệu chi tiết về MET và c-Met trong UTPKTBN
1.1. Sinh học phân tử của MET
MET nằm trên nhiễm sắc thể 7q31, mã hóa thụ thể tyrosine kinase c-Met
Cấu trúc gồm: vùng ngoại bào (nhận diện HGF), vùng xuyên màng, vùng kinase nội bào
Khi HGF gắn vào c-Met → dimer hóa thụ thể → phosphoryl hóa → kích hoạt các con đường:
PI3K-AKT: sống còn tế bào
RAS-RAF-MAPK: tăng sinh
STAT3: điều hòa miễn dịch, tăng sinh
SRC-FAK: xâm lấn, di cư
1.2. Các bất thường MET trong UTPKTBN
Đột biến exon 14 skipping: cản trở liên kết với c-CBL → kéo dài thời gian tồn tại của c-Met
Khuếch đại MET: tăng phiên mã → tăng biểu hiện protein
Biểu hiện quá mức c-Met (IHC ≥25% tế bào nhuộm mạnh, 3+): không đồng nhất với khuếch đại/đột biến
1.3. Phát hiện c-Met và bất thường MET
IHC (protein): Teliso-V sử dụng IHC để lựa chọn bệnh nhân
FISH (gen): phát hiện MET amplification
NGS: phát hiện đột biến exon 14 và các biến thể khác
2. Telisotuzumab Vedotin (Teliso-V): Cơ chế tác động và phát triển
2.1. Cấu trúc thuốc
Kháng thể đơn dòng telisotuzumab chống c-Met
Liên kết dipeptide cleavable
Monomethyl auristatin E (MMAE) – chất độc chống vi ống mạnh
2.2. Cơ chế hoạt động
Gắn vào tế bào biểu hiện c-Met
Nội bào hóa → liên kết bị phân cắt trong lysosome
Giải phóng MMAE → ức chế polymer hóa vi ống → chết tế bào theo cơ chế apoptotic
2.3. Ưu điểm ADC thế hệ mới
Chọn lọc mô đích
Hoạt động không phụ thuộc đột biến kinase
Giảm độc tính hệ thống so với hóa trị thông thường
2.4. Quá trình phát triển
Pha I (Strickler et al.): an toàn, hoạt tính bước đầu trong nhiều loại u
Pha II – LUMINOSITY: trọng tâm vào UTPKTBN biểu hiện c-Met
Pha III – TeliMET đang diễn ra
3. Thử nghiệm lâm sàng pha II – LUMINOSITY
3.1. Thiết kế
Giai đoạn I: đánh giá khả thi (go/no-go)
Giai đoạn II: nhóm mở rộng: UTPKTBN không tế bào vảy, EGFR-wildtype, IHC ≥25%
3.2. Phân tầng
Nhóm c-Met cao: IHC ≥50% tế bào 3+
Nhóm trung bình: 25–49% tế bào 3+
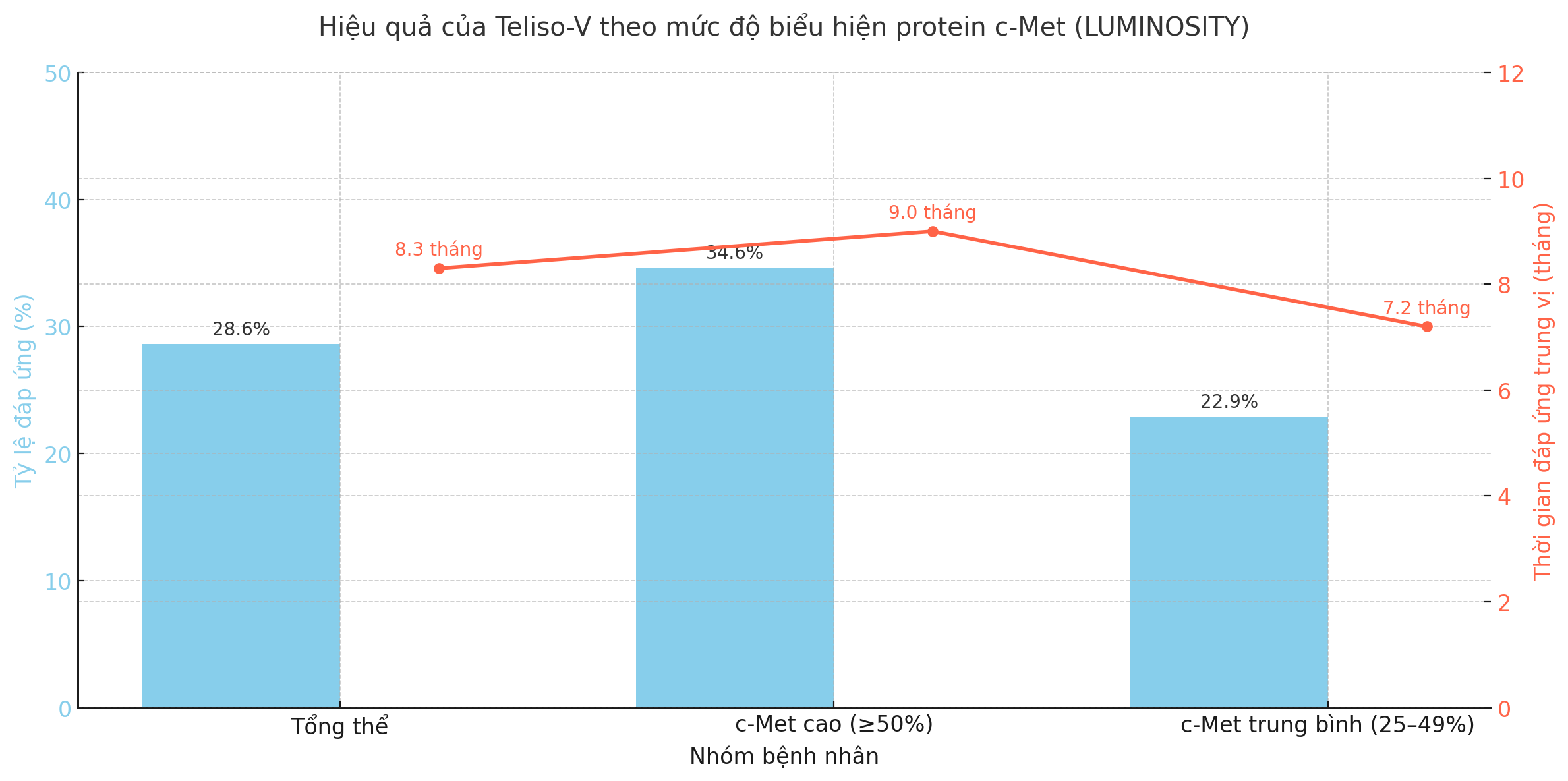
3.3. Kết quả chính
ORR toàn bộ: 28.6%
Nhóm c-Met cao: 34.6%
Nhóm trung bình: 22.9%
DOR trung vị: 8.3 tháng (cao nhất 9.0 tháng)
PFS: 5.5–6.0 tháng
OS: ~14.5 tháng
Đáp ứng duy trì ≥6 tháng: >60% nhóm c-Met cao
3.4. Độc tính
Độ ≥3: 27.9%
Phổ biến: bệnh thần kinh ngoại biên, viêm phổi mô kẽ, tăng men gan
So với các ADC khác (TROP2): ít gây viêm phổi hơn
4. So sánh Teliso-V với Docetaxel và ADC khác
4.1. Với Docetaxel
| Yếu tố | Docetaxel | Teliso-V |
|---|---|---|
| ORR | 7–14% | 28.6% (cao nhất 34.6%) |
| PFS | 2.9–3.5 tháng | 5.5–6.0 tháng |
| OS | <10 tháng | ~14.5 tháng |
| Độc tính chính | Suy tủy, sốt, mệt | Thần kinh ngoại biên, viêm phổi mô kẽ |
4.2. Với các ADC khác
Sacituzumab govitecan (TROP2-ADC): ORR thấp hơn, độc tính đường tiêu hóa cao hơn
T-DXd (HER2-ADC): mạnh hơn nhưng viêm phổi mô kẽ nghiêm trọng hơn
Teliso-V là ADC đầu tiên dùng protein c-Met (không cần đột biến) làm chỉ dấu chọn bệnh nhân
5. Triển vọng tương lai và nghiên cứu phối hợp
5.1. Vị trí hiện tại
Lựa chọn hàng hai/hàng ba ở UTPKTBN không tế bào vảy, EGFR-wildtype, IHC c-Met ≥25%
5.2. Đang nghiên cứu
Pha III TeliMET: Teliso-V vs docetaxel (NCT04928846)
Phối hợp osimertinib ở bệnh nhân có EGFR đột biến + c-Met overexpression (NCT04928833)
Kết hợp với thuốc miễn dịch (anti-PD-1/PD-L1)
5.3. Định hướng
Phát triển xét nghiệm companion diagnostics tích hợp IHC + gen
Mở rộng sang các loại ung thư khác: dạ dày, đại trực tràng, vú
Tối ưu hóa chiến lược kiểm soát độc tính thần kinh
6. Kết luận chuyên sâu
Telisotuzumab vedotin là đại diện tiêu biểu cho ADC thế hệ mới, định hướng điều trị dựa trên biểu hiện protein thay vì đột biến gen. Với hiệu quả rõ rệt và độc tính được kiểm soát, Teliso-V cung cấp giải pháp cá thể hóa điều trị cho nhóm bệnh nhân UTPKTBN trước đây không có lựa chọn tối ưu. Việc sử dụng IHC làm chỉ điểm chọn bệnh nhân giúp mở rộng áp dụng thực hành lâm sàng, đặc biệt tại các trung tâm không có kỹ thuật giải trình tự gen.
Tài liệu tham khảo
Camidge DR, et al. J Clin Oncol 2024;42(25):3000-3011
ClinicalTrials.gov: NCT03539536, NCT04928846
Garon EB, et al. Lancet 2014;384:665-673
Reck M, et al. Lancet Oncol 2014;15:143-155
Strickler JH, et al. Cancer Discov. 2018;8(8):943-953
Hirsch FR, et al. J Thorac Oncol. 2017;12(1):15–26
Herbst RS, et al. Nature. 2018;553:446–454
Cần tư vấn chuyên sâu về các thuốc điều trị ung thư phổi:
- ThS – BS Trần Khôi
- Bệnh viện Phổi Hà Nội – 44 Thanh Nhàn, Hai Bà Trưng
- Zalo: 0983 812 084 – Hotline: 0913 058 294
- Facebook: Bác sĩ Trần Khôi
- Kênh YouTube: Thạc sĩ Bác sĩ Trần Khôi – Chữa bệnh ung thư phổi




